|
<解説記事ダウンロード>
<概要>
1980年代末から始まり、90年代を通して我が国で行われた精力的な基礎研究と技術開発によって、バイオ技術分野における新しいイオンビーム利用技術が開発された。その中には、実用技術にまで育ったイオンビーム育種技術、基礎研究に有力な手段を提供するシングルイオン細胞照射技術、細胞内元素分布の高感度計測を可能にした大気マイクロPIXE分析技術、ポジトロン放出核種を利用して生きたままの植物の機能を非破壊的に計測するポジトロンイメージング技術などがある。これらの技術はバイオ技術分野において新しい放射線利用手段を提供しつつある。 <更新年月> 2005年01月
<本文>
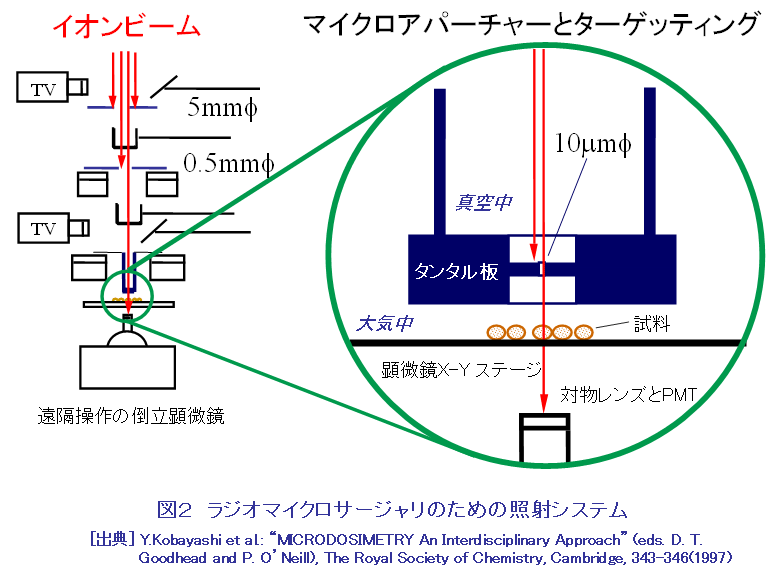
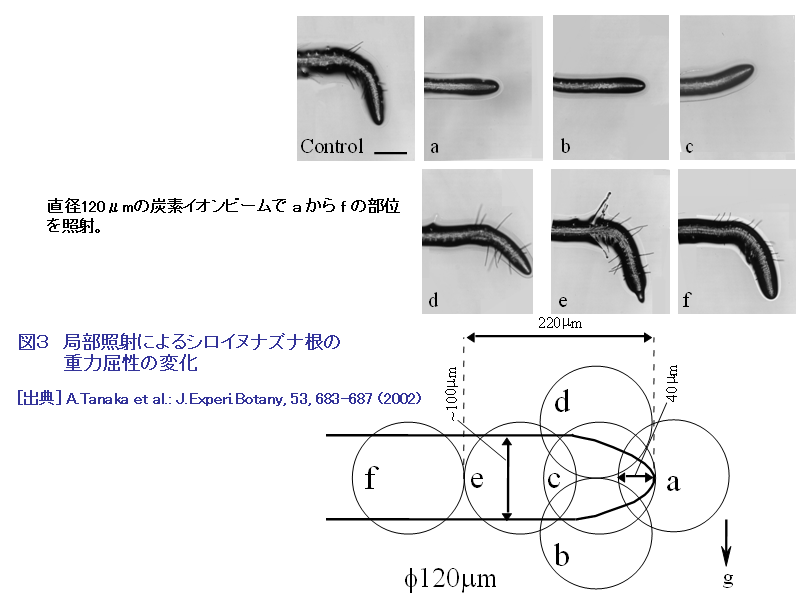
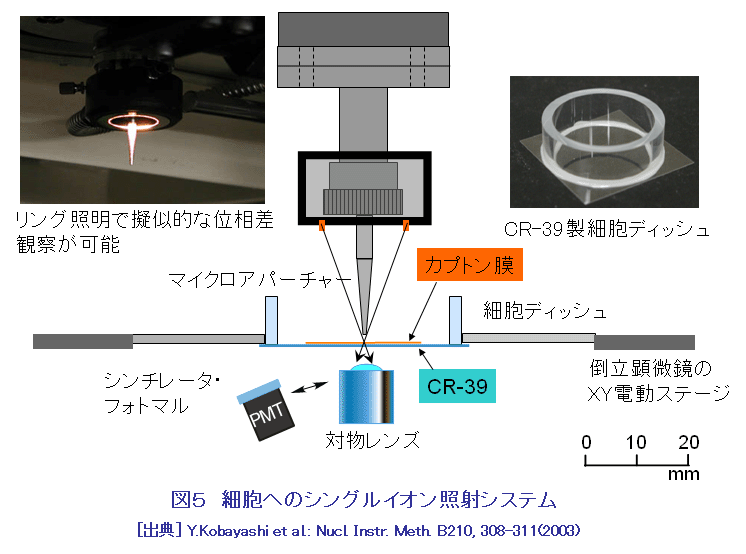
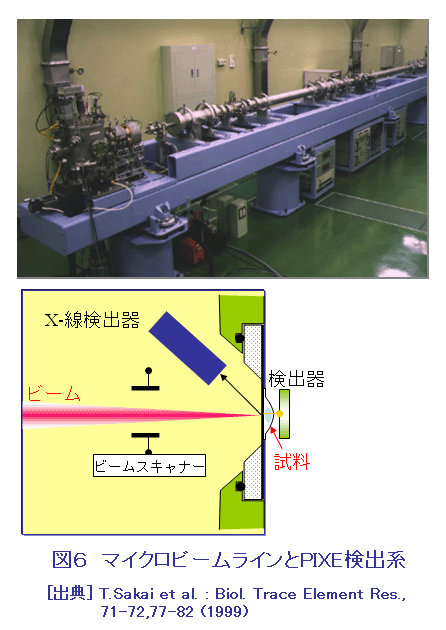
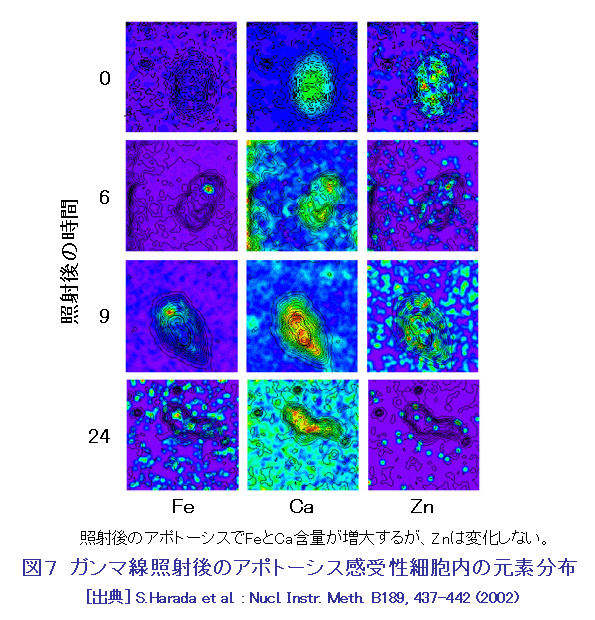
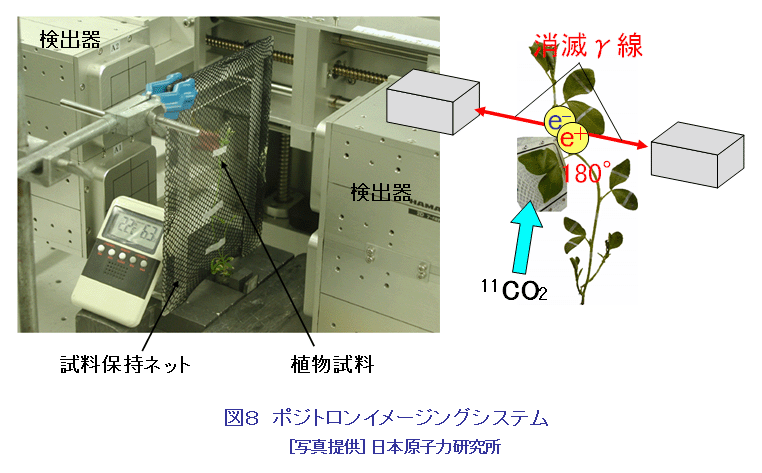
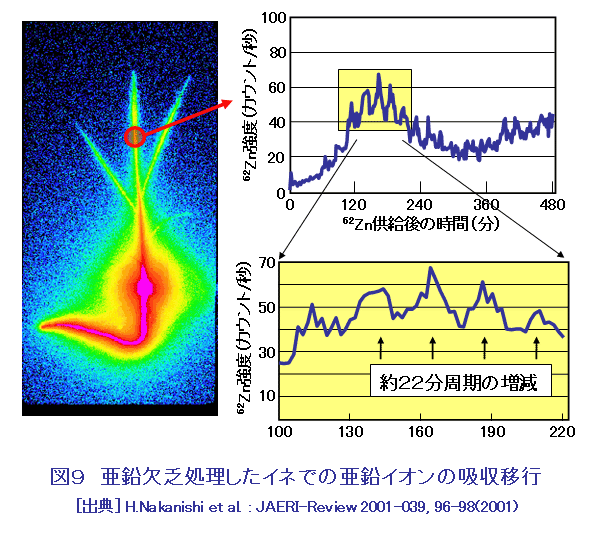
イオンビームは、医療分野ではすでに粒子線治療に活用され、またイオンビーム照射で作られる短寿命RIがPETなどの核医学診断においても活用されているが、バイオ技術分野での利用は進んでいなかった。1980年代末に始まり90年代を通して我が国で行われた精力的な基礎研究と技術開発によって、近年当該分野における新しいイオンビーム利用技術が開発されてきている。 1.イオンビーム育種技術 放射線による植物の品種改良には、これまで主にX線、ガンマ線、中性子線などが使われている。イオンビーム育種は、放射線としてイオンビームを使うことを特徴とする品種改良技術で、1987年から研究開発が始まった純国産技術である。イオンビームだけを従来の放射線と区別する理由は、次のような3つの特徴があるからである。 (1)多種多様な品種の作出:ガンマ線などに比べて、イオンビームでは突然変異スペクトルが広く、多様な突然変異を引き起こすことが出来るので、これまで作れなかった新しい形質の品種を効率よく作り出せる可能性が高くなる。キクの場合には、ガンマ線では作ることが出来ない複色(複数の色が混ざり合う花)や条斑(花弁に異なる色の条斑が入ったもの)の花を咲かせる品種を作ることができる(表1)。 (2)選抜作業の効率化:イオンビームでは突然変異率がガンマ線などに比べて数倍から数10倍高くなるので、少ない試料を使って効率良く目標とする改良が達成できる。最初に扱う個体数が少ないため、広い栽培施設や圃場が不要になり、また少ない労働力と短い選抜期間で品種改良ができるというメリットがある。 (3)育種期間の短縮:イオンビームで作った突然変異体には目的とする形質変化以外に付随する変異が少ないという特徴がある。例えば、照射した花粉を受粉させて雑種を作るときに、ガンマ線で花粉を照射すると萼や葉形などに両親とは違った変異が見られるが、イオンビームで照射した花粉では両親の形質だけを受け継ぐ雑種となる(表2)。ガンマ線の場合には、不要な変異を取り除くために戻し交雑などを繰返し行わなければならないので、新品種を作り上げるのに10年近い歳月が必要となる。しかし、イオンビームで作った突然変異体では、付随する不要な変異が起こりにくいので、早いものでは2年くらいで新品種を作り上げることができ、育種期間を大幅に短縮することができる。 イオンビーム育種技術を用いて2002年に、種子を作らないで花持ちが良いバーベナが理化学研究所とサントリーフラワーズとの協力で開発され、商品化された(図1)。同じ年に、色変わりのカーネーションが日本原子力研究所(現日本原子力研究開発機構)とキリンビールとの協力で商品化され(図1)、更に同じ年の秋には日本原子力研究所と農業生物資源研究所放射線育種場が共同で、キクの花色新品種の実用化を達成した。2003年には、鹿児島県バイオテクノロジー研究所が側枝の出ない冠婚葬祭用白輪菊の育成に成功し、翌年に実用化した。現在、イオンビーム育種のために利用できる国内の照射施設は、日本原子力研究所高崎研究所(現日本原子力研究開発機構高崎量子応用研究所)のイオン照射研究施設(TIARA)、理化学研究所の加速器研究施設(RARF)、放射線医学総合研究所の重粒子線がん治療装置(HIMAC)などの3施設である。また、学会として「イオンビーム育種研究会」が発足している。 2.シングルイオン細胞照射技術 イオンビームをミクロンサイズにまで絞込み、1個のイオンを細胞核や細胞内器官に照射して、その生物影響を調べようとする試みは1950年代からあった。なぜなら従来のランダム照射による確率論的解析には限界があったからである。30年ほどの沈黙を破って、80年代に技術開発が復活したが、実際にはコンピュータなどの周辺技術が進歩した90年代に入って開発が加速された。米国コロンビア大学は、ラドンからのα線のリスク評価に係わる基礎データを取る目的で陽子、ヘリウムなどの軽イオンマイクロビームの形成を目指し、英国グレイ癌研究所は、ガン治療の基礎データを取る目的で、同じく陽子とヘリウムのマイクロビーム化を目指した。日本原子力研究所(現日本原子力研究開発機構)は、バイオ技術に活用するためのマイクロサージャリ技術の開発を主目的とし、同時に生物に対するLET効果を調べるために、炭素以上の重イオンのマイクロビーム化を目指した。我が国で最初に開発されたラジオマイクロサージャリ用照射システム(図2)から得られる40〜120μm径のビームを用いて、植物根の重力屈性の解析が行われ、根端にあるセンサー細胞から伸長細胞へのシグナル伝達が重力方向に局在する細胞を通って伝わることが見出された(図3)。また、蚕受精卵の発生過程の解析では、局部照射によって細胞性胞胚期における運命予定地図を作成し、卵の腹側中央部に発生分化を指令するセンター機能があることを明らかにしている(図4)。その後システムの高度化が進められ、現在では5μm径まで絞ったビームで、一度に数百個の細胞を連続的に±1μmの精度で自動照準してシングルイオンで照射できるように改良された(図5)。すでにシングルイオン細胞照射技術を確立しているのは、上記の日米英の3拠点だけであるが、海外ではドイツ、フランス、イタリア、中国などで、国内では放射線医学総合研究所、若狭湾エネルギー研究センターなどで開発が進んでいる。シングルイオン照射の研究から、細胞間の放射線影響伝達(バイスタンダー効果)が見つかり、また重イオンでは1個のイオンでも充分な細胞殺傷能力があることが分かってきている。シングルイオンの影響解析は、低線量の生物影響の解明、長期有人宇宙飛行での宇宙線リスク評価、効果的な粒子線治療法の開発などに不可欠な基礎データを提供することになる。 3.大気マイクロPIXE分析技術 陽子ビームを真空中で試料に照射して元素分析を行うマイクロPIXE分析技術は、すでに確立していた。しかし、真空中では生きたままの状態の細胞を分析できない。そこでイオンビームを細く絞って大気中に取り出し、高精度で照射できるシステムの開発が日本原子力研究所(現日本原子力研究開発機構)で行われた。その結果、1μmの空間分解能で分析できる大気マイクロPIXE分析システムが世界で初めて開発された(図6)。このシステムを用いて細胞内に取り込まれた薬剤の細胞内分布を実測することが可能になり、またアポトーシス(細胞の自爆死)が起こる過程をFeやCa元素の動態から解析することもできることが明らかになった(図7)。この分析技術は、医療診断技術として役立つことが期待されることから、医学・生物学系の研究者がプロジェクトを組んで、積極的な技術開発が進められている。 4.ポジトロンイメージング技術 高エネルギーイオンビームをターゲットに照射して作られる短寿命RI、特にポジトロン放出核種は、医療分野ではすでにポジトロン放出断層撮影(PET)として実用化されているが、この技術を生きたままの植物機能のリアルタイム計測に応用する技術開発は世界的に例がなかった。日本原子力研究所(現日本原子力研究開発機構)と浜松ホトニクスの協力によって、世界で最初の植物用ポジトロンイメージング装置(PETIS)が開発された(図8)。この装置の完成によって、鉄欠乏条件下でのオオムギにおけるメチオニンの吸収・移行を画像化することに成功し、ムギネ酸の合成には葉ではなく、根の中のメチオニンだけが利用されることが分かった。また、植物中での金属イオンは、特定のイオン欠乏条件下では、約22分周期で脈動しながら移行するという現象が発見された(図9)。リアルタイム計測でないと見つからなかった現象である。それ以外にも光合成産物の転流、硝酸態やアンモニア態窒素の移行などが可視化できるようになっており、最近では定量的な解析も可能となった。新しい計測手段が植物機能の新しい側面を浮かび上がらせることが期待される。 <図/表> 



<関連タイトル> 生物学における放射線利用 (08-01-04-04) PETの原理と応用 (08-02-01-04) 放射線照射による農作物の品種改良(放射線育種) (08-03-01-01) 放射線による植物機能の解明 (08-03-01-05) 放射線による植物への影響 (09-02-01-05) 放射線の種類と生物学的効果 (09-02-02-15) 放射線と突然変異 (09-02-06-02) <参考文献> (1)渡辺 宏:イオンビームバイオ技術の現状と動向、Radioisotopes,53(5),p.295-305(2004) (2)S.Nagatomi et al. : JAERI-Review 96-017,p.50-52(1997) (3)M.Inoue et al.: JAERI TIARA Ann. Rep.,3,p.44-45(1993) (4)鈴木賢一ほか:放射線と産業、99,p.40-45(2003) (5)岡村正愛:放射線と産業、99,p.46-53(2003) (6)田中淳:放射線と産業、99,p.4-10(2003) (7)Y.Kobayashi et al.: ”MICRODOSIMETRY An Interdisciplinary Approach”(eds. D. T. Goodhead and P. O’Neill),The Royal Society of Chemistry,Cambridge,p.343-346(1997) (8)A.Tanaka et al.: J.Experi.Botany,53,p.683-687(2002) (9)K.Kiguchi et al. : Nucl. Instr. Meth. B210,p.312-315(2003) (10)Y.Kobayashi et al.: Nucl. Instr. Meth. B210,p.308-311(2003) (11)T.Sakai et al. : Biol. Trace Element Res.,p.71-72,p.77-82(1999) (12)S.Harada et al. : Nucl. Instr. Meth. B189,p.437-442(2002) (13)内田 博ほか:放射線と産業,80,p.6-10(1998) (14)松橋信平ほか:放射線化学,70,p.20-25(2000) (15)石岡典子:放射線と産業,80,p.11-15(1998) (16)H.Nakanishi et al. : JAERI-Review 2001-039,p.96-98(2001) (17)イオンビーム育種研究会HP:
|

