|
<解説記事ダウンロード>
<概要>
PET(Positron Emission Tomography、陽電子断層撮像法)は、核医学検査法の一つである。X線CTが、放射線源を人体の外部に置いて放射線の透過量を測定するのに対して、核医学検査法では、放射性薬剤の投与により人体内部の特定の臓器に分布した放射性同位体の位置を体外に放出される放射線によって測定する。PETは、放射性同位体(陽電子放出核種)で標識した薬剤を放射線源とする。陽電子は近くの電子と結合して消滅し、その場所から透過力の強いガンマ線2本が互いに反対方向へ飛び去る。この一対の放射線を人体周囲に並べた検出器で同時に計数し、そのデータからX線CTと類似の計算方法を用いて、放射線源の体内集積度を3次元的に再構成する。標識薬剤としては、水やブドウ糖、アミノ酸などが用いられる。これらを体内に極微量投与してPET装置で放射能測定を行い、体内の局所放射能が変化する様子を観察することによって脳や心臓など臓器の機能を評価でき、がんを早期に発見できるなどの特徴がある。 <更新年月> 2012年02月
<本文>
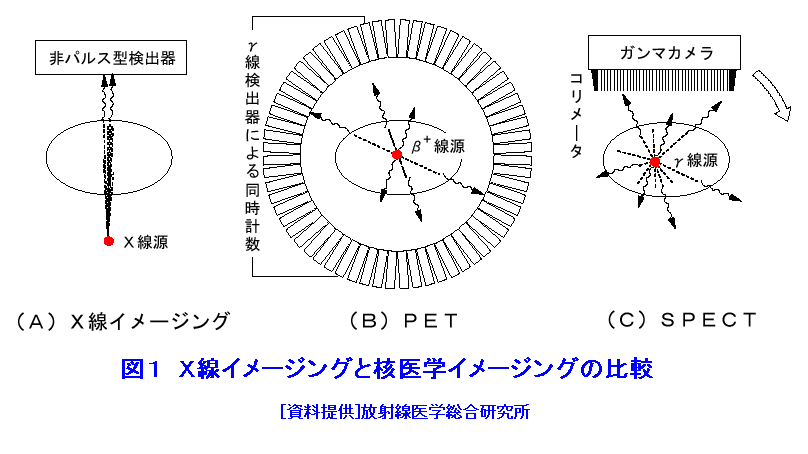
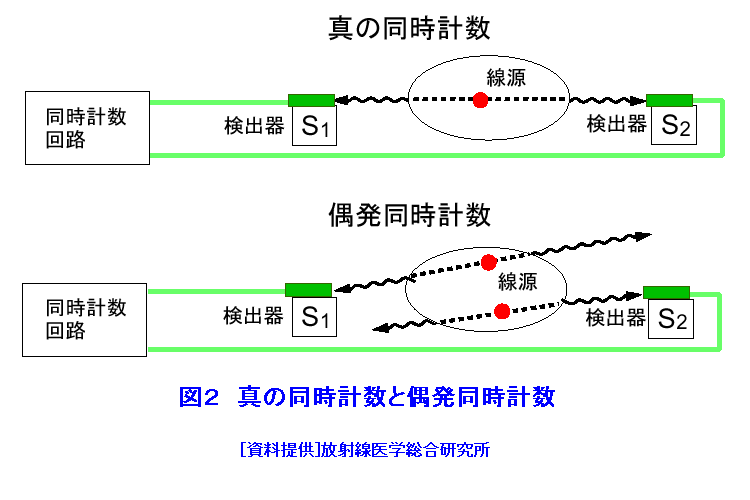
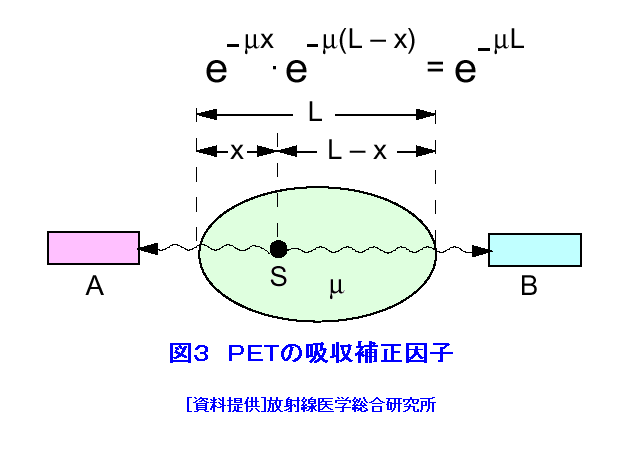
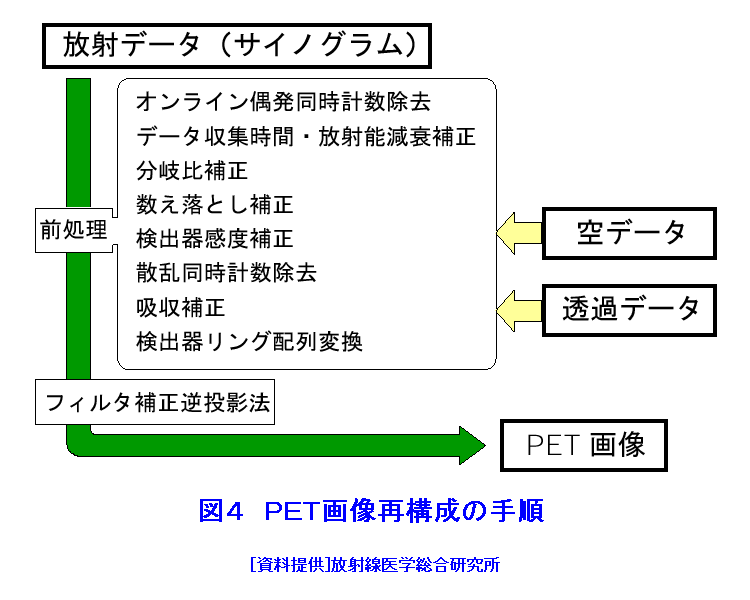
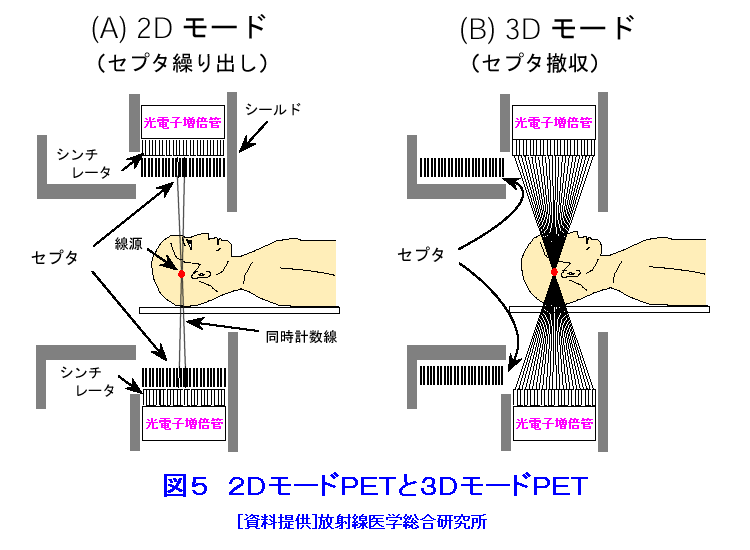
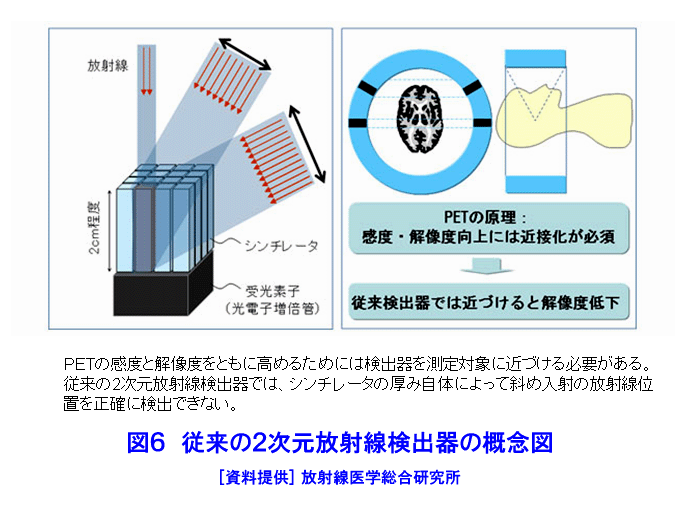
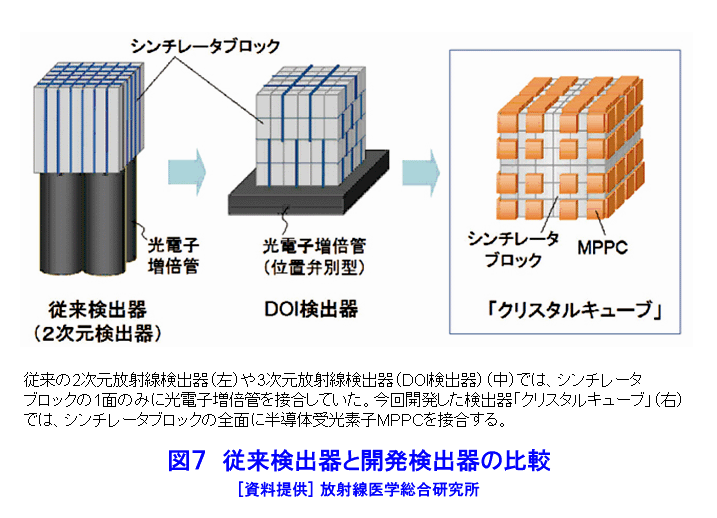
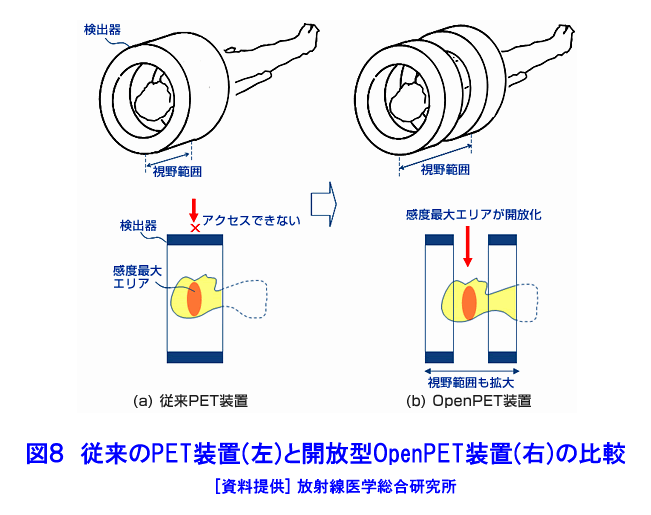
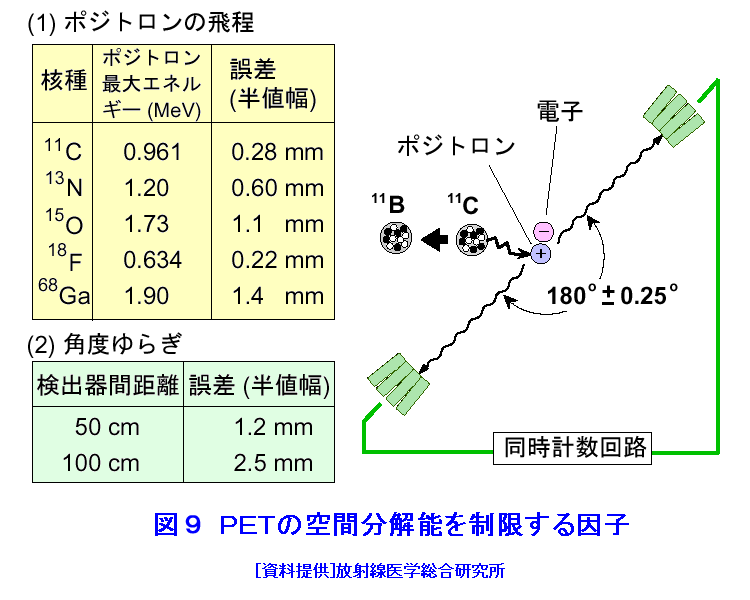
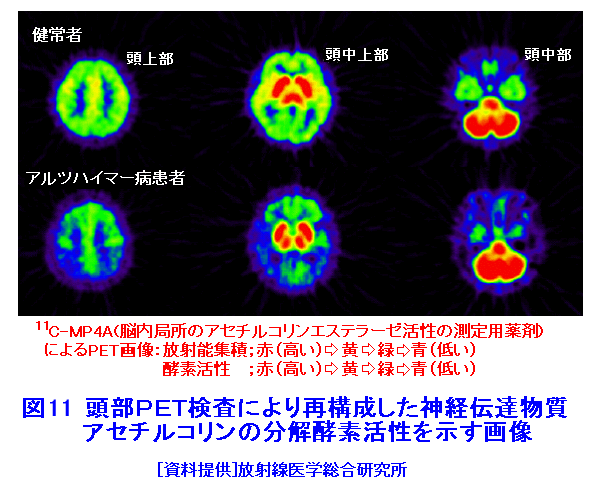
1.PETの原理 (1)歴史的背景 陽電子を放出する放射性薬剤を人体に投与して、その体内分布を測定する試みは1950年代に始まり、断層像として再構成するための技術開発が1960年代からなされてきた。しかし、核医学検査に伴う複雑さのために画像再構成法の進歩は手間取り、X線診断の方が先に断層撮像法を開発し、1972年にはX線CT装置として臨床に利用された。X線CTの技術から生み出された画像再構成法を取り入れて、1975年にPET装置が初めて開発され、核医学検査に使用されるようになった。しかし、単にX線CTの技術を転用するだけではPETのもつ潜在能力を十分に引き出すことはできなかった。1980年代後半からは画質をより向上するために、PETがもつ本来の特徴を活用する独自の画像再構成法及び装置の研究開発が進められた。 (2)陽電子放出放射性同位体 陽電子を放出する放射性同位体である18F、15O、11C、13Nは、陽子や重陽子を10MeV〜20MeVで加速できる小型サイクロトロンで製造する。フッ素、酸素、炭素、窒素などは生体を構成する元素であり、生体活性物質などに標識することが容易である。これらは、数分から数時間で壊変する短寿命の放射性同位体であるため、放射性薬剤を短時間で製造する自動合成装置が必要である。表1に、陽電子を放出する主な放射性核種とその半減期及び放射性薬剤を示す。 (3)消滅放射線 陽電子は体内(臓器内)ですぐ止まり直接検出することは難しいが、組織近くの電子と結合して消滅する際に、電子の静止質量相当のエネルギー(511keV)をもつ極めて短い波長(2.43pm)の電磁波(光子)を2つ放出する。エネルギーの大きいこの光子は消滅放射線と呼ばれ、陽電子消滅のあと互いに反対方向(180度)に飛び去るため、対向する2つのガンマ線検出器(NaI(Tl)、Bi4Ge3O12(BGO)、Lu2SiO5(LSO)などをシンチレータとする)により一対の消滅放射線を同時に検出すれば、消滅した陽電子はガンマ線検出器を結ぶ線(同時計数線)上にあったことが同定できる。X線診断で通常使用される光子と比べて消滅放射線のエネルギーは5〜10倍高いので透過力が大きい。たとえば、体表面より14cmの深さに線源がある場合に吸収も散乱もされずに体から直進して検出器に向かう光子の割合は、診断用X線では約4%と低いのに対して消滅放射線では25%と高い。ただし、検出する側から見れば、透過力の高い光子ほど高感度の検出器を実現することが難しくなる。 (4)X線CTと比べた特徴 光子エネルギー以外にX線診断とPET検査が本質的に異なる第1の点は、求める未知量の数が多いことである。X線CTは、透過したX線量の割合から体内吸収係数の分布を描出するもので未知量は1種類である(図1A)。一方PETでは、体内放射能濃度分布と吸収係数分布の2種類となる(図1B)。異なる第2の点は、放射線照射の方向が制御可能か否かである。X線診断では線源を生体の外部より照射し、対向する位置に検出器を配置するが、PET検査では放射性薬剤を生体に投与するため放射線源が生体内にあり、放射線が放出される方向を制御することはできない。異なる第3の点は、電流計測かパルス計測かの違いである。PETでは同時計数を行う必要から消滅放射線をパルス計測する。一対の検出器から出る2つのパルス信号がある時間幅内に到達したことで同時計数は行われるが、独立した陽電子消滅事象による信号が偶然その時間幅に飛来する可能性がある(図2)。これは偶発同時計数と呼ばれ、真の同時計数にノイズとして加わる。偶発同時計数を低減するために検出器に高い時間分解能をもつことが要求される。時間分解能及び検出効率の高い検出器を実現するために、PET用検出器は特有の発展を遂げてきた。 PETがパルス計測を基にしていることに起因して、計測データ自体に確率的要素が内在しており、その統計ノイズにPET画像が左右される点もPETの大きな特徴である。近年は、X線CTとは異なる放射線測定の条件を考慮したPET特有の画像再構成法が開発されたため、生成画像の質が向上してきた。 (5)SPECTと比べた特徴 核医学検査で広く利用される放射性同位体99mTcなどは、単一ガンマ線を放出するので、その方向を知るためにガンマ線検出器の前にコリメータを置く。これを人体に沿って走査し、放射性同位体の体内分布を再構成するのが、SPECT(Single Photon Emission Computed Tomography、単一光子放射断層撮像法)である(図1C)。SPECTでは、感度と解像度を同時に向上させることが困難である。たとえば、コリメータの穴を小さくすれば解像度は向上するが感度は低下する。一方、PETでは同時計数法という電気的なコリメータの採用により、幾何学的なコリメータを使用するSPECTに比べて解像度が高く、大幅に感度を高めることができる。感度と解像度をともに向上できることは、PETのもつ優れた点の一つである。 同時計数の損なわれる吸収補正因子は、図3に示すように体内における点Sで生じた1対の消滅放射線が検出器対A、Bで検出されるそれぞれの吸収補正因子の積で表わされるため、線源の位置に依存せず、検出器間で見込む吸収体の組成、形状のみで決定される。このためPETであれば、外部線源によってX線CTと同様の原理で吸収補正因子を正しく測定できるが、同時計数をしないSPECTでは不可能である。2種類の未知量のうち、吸収係数分布のみ切り離して測定ができるので、吸収を受けない放射能の投影データが算出可能であり、画像再構成問題を放射能濃度分布という1種類の未知量に関する問題として処理できる。図4に一般的なPET画像再構成処理の手順の概略を示す。投影データを補正するために、通常は放射データのみでなく、被検体のない空データ及び外部線源による透過データを別途収集する。前処理の終えた投影データを基に画像再構成を行う。 (6)2DモードPET 2DモードPETとは、X線CTの方法を適用した手法であり、体軸に直交する放射線のみを検出してスライス画像を得る平面計測法である(図5A)。体を囲む多角形もしくは円形に沿って検出器を稠密に配列した検出器リングが一般に使用される。検出器リング内の検出素子間で同時計数データを収集し投影データの計数を稼ぐ。検出器リングを多層に重ねることで同時に連続したスライスの投影データが得られるため、スライスごとに2次元画像再構成を行うことにより3次元再構成画像を得ることができる。ただし、体軸と直交しない大部分(99%以上)の放射線が検出されない点は、多層検出器リングにしても同じである。検出器リングの間に円環状の鉛板(セプタ)を挿入する理由は、各スライスごとに線源の検出領域を制限して偶発同時計数を低減するためである。 (7)3DモードPET 3DモードPETとは、どの向きの放射線でも検出しようとするPET独自の立体計測法である(図5B)。PETの原理に立ち戻り、X線CTの方法とは異なる3次元画像再構成法が研究開発されたため利用可能となった。しかし、PET用の放射能検出器は、放射線を微弱な光に変換するシンチレータと、光を電気信号に変換する受光素子から成り立っている。PETの感度と解像度をともに高めるためには、検出器を測定対象に近づける必要がある。しかし、従来の検出器で高感度を得るためには、シンチレータの厚みを2cm程度とする必要があり、近接した場合に解像度が低下するという問題があった(図6)。そこで、この問題を解決し、3次元PETを可能にした「クリスタルキューブ」という検出器が開発された(図7)。この検出器は、1辺1mmという微小な立方体形状のケイ酸ルテチウムイットリウム(LYSO)単結晶シンチレータを16×16×16に並べたシンチレータブロックの6面すべてに半導体受光素子を接合したもので、シンチレータ内部の放射線3次元位置を縦・横・深さ各方向ともに同等な解像度で得られるようになっている。その結果、PET用検出器として究極とも言える1mmの解像度を得られている。 (8)開放型PET 開放型(Open)PET(図8)は、検出器リングを体軸方向に2分割して開放空間を3次元に画像化する装置で、3次元放射線位置(DOI:Depth of Interaction)検出器(図5B)と組み合わせることにより、開放化しても優れた分解能を維持することが可能である。開放部分を通して治療ビームを照射しながら標的内部の照射ビーム自体を3次元的に画像化できることになる。特に、重粒子線や陽子線による粒子線がん治療は、周囲の正常組織を避けてがん病巣に線量を集中できる理想的な放射線治療法であるが、実際の患者体内において、毎回の照射が治療計画どおりの線量分布になっているかどうかを外部から検証する方法は確立していない。 このため、照射ビームと標的の原子核反応により患者体内で陽電子放出核種が生成される物理現象を利用したり、標的内部の照射ビームの様子をPETの原理により画像化する試みがなされてきたが、対向型のポジトロンカメラを用いたこれまでの研究では3次元の画像化は困難であった。しかし、OpenPETを用いれば、開放部分を通して治療ビームを照射しながら、標的内部の照射ビーム自体を3次元的に画像化できると考えられる。(独)放射線医学総合研究所の重粒子線がん治療装置HIMACで、OpenPETの小型試作機を用いて、人体に見立てた模型に放射化させた重粒子線を照射する実験を行い、標的に入射した重粒子線を3次元画像化することに成功した。 2.解像度と感度 実際には、同時計数した検出器を結ぶ線上に陽電子を放出する放射性同位体があるわけではない。陽電子の飛程と消滅放射線の角度揺動がその原因である(図9)。陽電子が放射性同位体から放出されて、止まるまでの距離を飛程という。また、陽電子が静止した場所で原子の軌道電子と結合し生み出される一対の消滅放射線は、軌道電子が持っていた運動エネルギーのために完全な逆向き飛行とはならず180度よりずれる。これを対消滅放射線の角度揺動という。PET画像の解像度は、この陽電子の飛程と対消滅放射線の角度揺動のために1mmより小さくすることが難しく、特に検出器間距離が大きいと角度揺動の影響はその距離に比例して大きくなる。小動物用PET装置では2mm以下の解像度も可能であるが、現状の臨床用PET装置では5mmの解像度が一般的である。解像度が向上しても統計ノイズは大きいために結局は画像の平滑化をすることになる。より一層の感度の向上が望まれている理由の一端がここにある。 物質量1モル当たりの放射能を比放射能(Bq/mol)と呼ぶ。たとえば11Cの場合、半減期が20.4分であるから3.41×1020(Bq/mol)である。逆に、この値から11Cに関する10,000Bqの放射能は2.93×10-17モルに相当し、放射能測定により物質量がわかる。11Cの放出する消滅放射線を体外から検出する割合が仮に1000分の1であると仮定すると、その場合でも、1ピコモル(11pg)の物質量で1秒間に3.41×105カウント(34.1万カウント/秒)の計数を得るため、非常に感度の高い計測法であることがわかる。 3.PETの応用 血流やエネルギー代謝は、細胞の活動が盛んな部位で高く、衰えている部位では低くなる。放射性の15Oで標識した酸素や水、ブドウ糖の類似体である放射性の18Fで標識したフルオロ・デオキシ・グルコース(FDG)などを投与してPET検査をすると、酸素やブドウ糖の局所的な代謝活性を画像でみることができる(図10)。このように、脳や心臓などの局所の機能をPET画像で観察して正常画像と比較すれば、疾患に伴う異常を見つけることができる。特に、がん細胞は正常細胞より盛んに分裂を起こしブドウ糖代謝が盛んであるため、FDGはがんの病巣に多く集積する。このため、がんの部位がわかるだけでなく、病巣の大きさや進行度などがわかり、治療法を決めたり治療効果の判定に威力を発揮する。 また、神経伝達物質の類似体などに陽電子を放出する放射性同位体で標識をつけて投与すれば、神経受容体の状態などもみることができる(図11)。近年、分子イメージングと称し、DNA・蛋白質など分子の変化に基づいて、細胞レベルでの異常を組織臓器レベルでの異常に先だって早期に検出するために、PET検査を活用する研究が予防医学の観点から進められている。日本核医学会の推定では2012年1月31日現在、日本のPET施設は287か所に達している。ただし、この中には診療や検診を行わずに基礎研究のみ、あるいは基礎研究と臨床研究のみの施設も含まれている。 4.PETによる被ばく線量 PET検査では、陽電子を放出する放射性同位体で標識した薬剤を静脈注射もしくは呼吸により体内に吸入するため、わずかではあるが被ばくがある。たとえば、1回のFDG投与による2DモードPET検査では2.2mSv程度であり、X線CTと比べて低い被ばく線量である。被ばく線量は、3DモードPETのように高感度となるに従ってさらに低減化する傾向にある。特に、がんの転移を検査する全身PET検査は、外部から照射するX線CTとは異なって被ばく線量が増加することはないので、その利点が最大限に活かされる検査といえる。 (前回更新:2003年3月) <図/表> 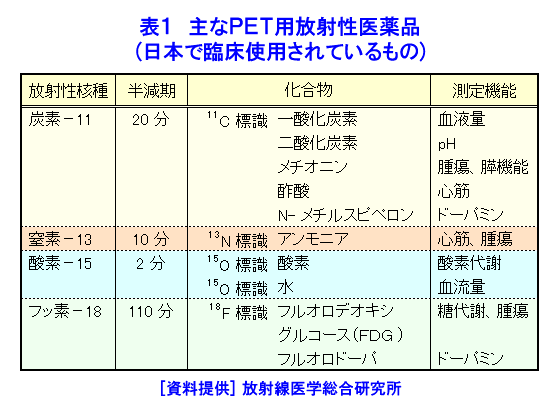

<関連タイトル> X線診断 (08-02-01-01) X線CT(X線コンピュータ断層撮影) (08-02-01-02) 医療分野での放射線利用 (08-02-01-03) <参考文献> (1)田中栄一:PETの現状と将来、RADIOISOTOPES、46(1997)、pp.733-742 (2)村山秀雄:ポジトロン・エミッション・トモグラフィ(PET)、放射線、24(2)、pp.31-44(1998) (4)日本核医学会(編):核医学検査Q&A(1997) (5)村山秀雄:立体計測型ポジトロン断層撮像法における画像再構成、光学、29、pp.366-371(2000) (6)村山秀雄:PETの放射線検出系, Med. Imag. Tech., Vol.18, pp.15-23(2000) (7)放射線医学総合研究所:平成13年度次世代PET装置開発研究報告書、2002.3 (8)放射線医学総合研究所:平成14年度次世代PET装置開発研究報告書、2003.3 (9)(独)放射線医学総合研究所:理論限界に迫るPET解像度の実現に向けた3次元放射線検出器を開発、2011年10月 (10)(独)放射線医学総合研究所:世界初開放型PET装置の実証に成功、プレス発表、平成23年1月
|

