|
<解説記事ダウンロード>
<概要>
哺乳類細胞の細胞分裂が起こるためには、細胞が実際に分裂する分裂期(M)に先立ってそのための準備期間とも考えられる十数時間以上の休止期または間期(R)が必要である。この過程が周期的に繰り返しされることにより細胞増殖が起こり、それにより多くの生体機能が保たれる。この分裂の周期は細胞周期と呼ばれ、G1,S、G2,Mという4つの時期(位相)がある。放射線の細胞分裂に及ぼす影響は、分裂期に対する直接的な効果ばかりでなく、休止期における照射の影響も非常に大きく、照射線量や照射時期によって引き続き起こる細胞分裂やその後の細胞の生存自体にも大きく影響する。細胞分裂遅延、染色体異常、分裂異常、小核形成、2核形成、巨大細胞化、間期死またはアポトーシス、分裂死、細胞周期による細胞致死率の変動、さらには晩期障害として突然変異、細胞のガン化などが起こる。 <更新年月> 2002年11月
<本文>
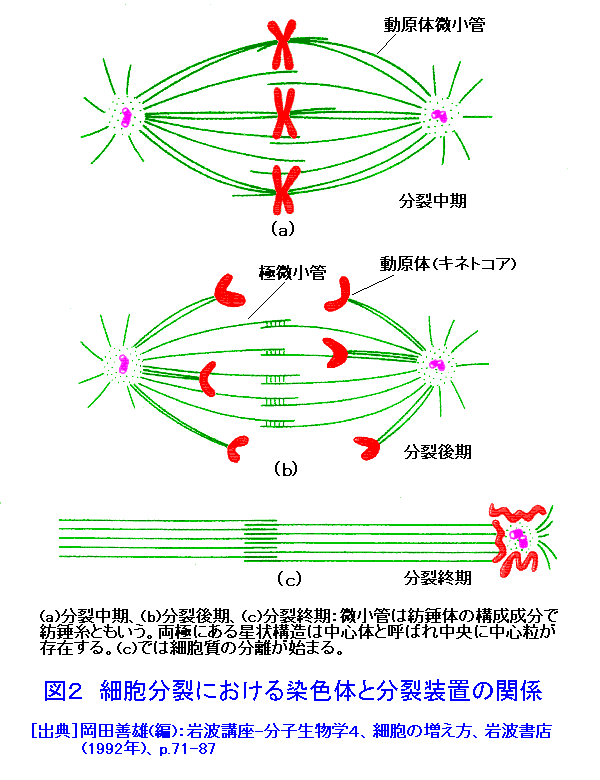
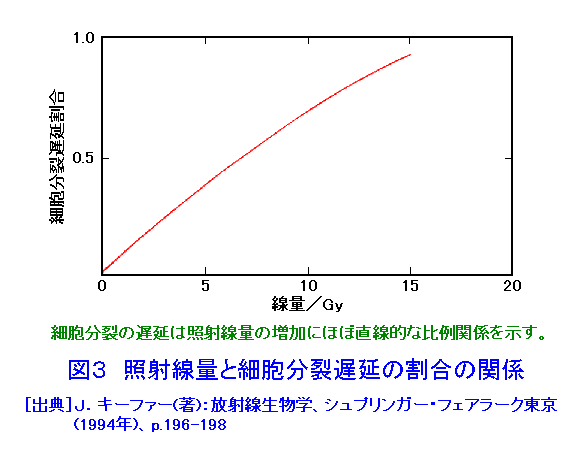
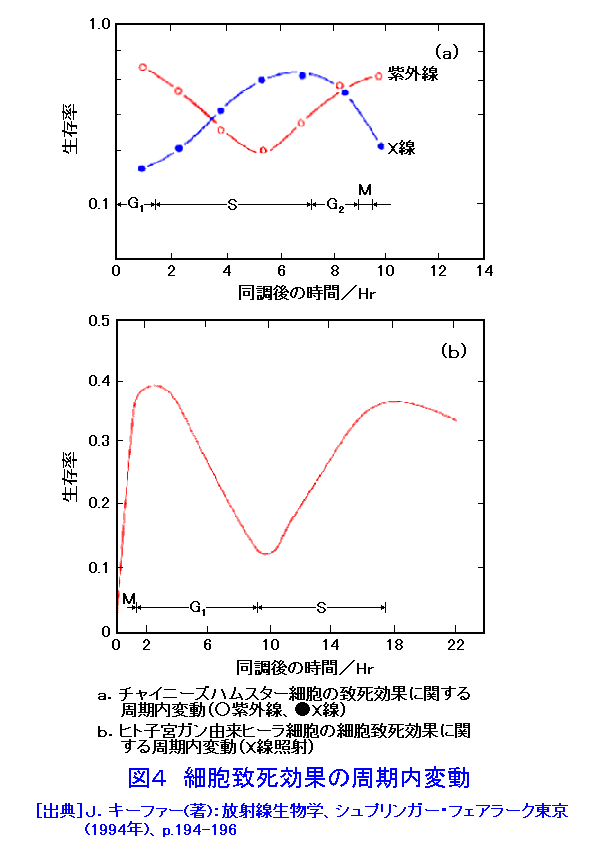
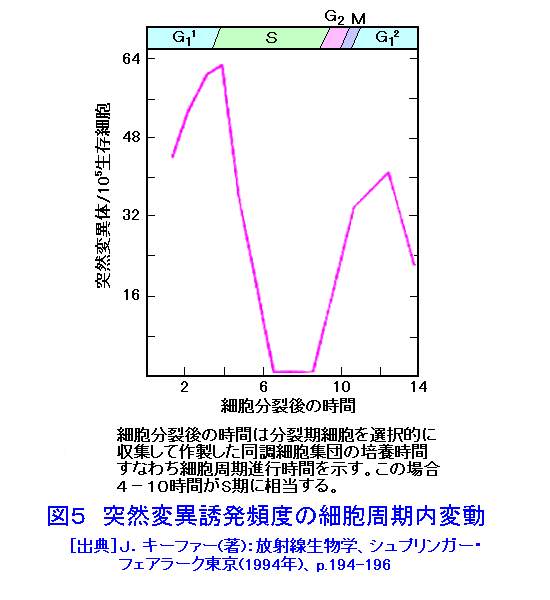
1.細胞分裂と細胞周期 細胞分裂は単細胞生物では個体の増殖法であるが、多細胞生物では個体の発生、生体機能の維持生殖細胞の形成などに、また組織細胞の損傷修復などに必須であり、生物にとっては非常に重要な事象である( 図1 )。顕微鏡で観察できるいわゆる有糸分裂期間、分裂期は半時間も掛からぬ短い時間に起こる劇的な現象であるが、この有糸分裂がおこるためにはそのための準備期間すなわち休止期または間期が必要となる。つまり、細胞が一度分裂すると次に分裂するための準備期間は、繰り返し分裂する培養細胞では最短でも10時間前後の時間が掛かっている。 通常、休止期は細胞が有糸分裂を終了した時点からG1期(ジーワン期と読む)、S期(エス期と読む;またはDNA合成期ともいう)、G2期(ジーツウ期とよむ)およびM期(エム期と読む)の4つの時期(位相)に区別されている。この中で細胞学的に顕微鏡下で区別し易い時期はM期とS期である。M期は有糸分裂過程そのものであるので100年前から顕微鏡観察され、あらゆる生物の教科書には必ず記載されている。因みに、M期は通常、前期、中期、後期、終期が区別されている( 図2 )。顕微鏡映画などでは通常M期の過程は半時間足らずで終わるが、細胞周期推定法では通常1時間以内に見積もられている。次いで、S期は細胞がDNAを複製する時期にあたり、DNA塩基の一つにあたる放射性チミジンを培養液や生体に加えると、これを細胞核内に取り込み新しいDNA鎖の合成に利用される。直ちに細胞を固定、放射線感光乳剤を細胞の上にかけて露出、現像すると、取り込まれた放射性チミジンの放射能を顕微鏡下で黒点として検知できる。この検定はS期のみに特異的であることから、取り込みが検知された細胞はDNAを合成していたと認定される。しかし、近年ではばらばらに分散した細胞を用いて、細胞に含まれるDNA量を特殊染色法とレーザービームにより瞬時に測定して自動的に細胞周期の解析をする機械と方法(フローサイトメトリー)が利用されている。これによると細胞周期時間や周期の各位相に分布する細胞の比率やその時期の経過時間までも瞬時に測定できる。これに対して、G1期やG2期は、それぞれ特徴的で識別可能なS期とM期の間に挟まれていることになるのでギャップと呼ばれ、M期の直後からS期までを1番目、S期とM期の間を2番目のギャップとしてG1,G2と名付けられ、RNA(リボ核酸)やタンパク合成活性が高く、G1期ではS期を誘導する特異的なタンパク合成、またG2期ではM期を誘導するに必須のタンパク合成があることは古くから知られているものの、これらの時期で起こる生化学的物質やその合成能の詳細はいまだ充分に明らかでない。近年、イースト菌細胞などを主として細胞周期に特異的な遺伝子活性の解析研究が著しい発展を見せており、一部の哺乳類細胞でも細胞周期特異的な遺伝子活性とタンパク合成に関する研究が盛んになっている。 正常組織細胞でも、腫瘍細胞や培養細胞でも分裂が起こる頻度は、その生育環境条件によって多様であるが、前者では一般に細胞周期の回転が生体維持のために正確に制御されているが、後者では細胞周期の回転は条件次第で無秩序に変化すると云ってよく、いわゆる生育条件がよいかあるいは制御因子が抑制されている条件では、細胞は細胞周期を無限に繰り返して増殖する。一般に、細胞周期を回転する制御因子はG1期に作用することが多く、G1期の長さが細胞周期の長さの決定要素になっている。しかし、時には細胞周期から外れている状態にある細胞も知られており、これらはG0期細胞と名付けられて区別されるが、これらの細胞が細胞周期を回転するためにはサイトカイン等の増殖因子である物質の作用を必要とする。 2.細胞周期における放射線の標的となる生体分子合成能と細胞死のモード 放射線が細胞機能に与える影響は、生化学的にはタンパク質や核酸など生体分子の部分にイオン化を起こし、その合成過程に異常を生じて目的の生体分子合成能が抑制を受けることが基本であろう。中でもS期のDNA合成能は放射線にもっとも感受性であり、次いでRNA合成能、タンパク合成能の順に感受性は低くなる。ヒトやマウスの培養細胞では細胞が10GyのX線を浴びると90%近くが致死的な損傷を被るが、そのほとんどはDNA合成の阻害(40−70%)またはDNAの遺伝的損傷によると考えられる。細胞分裂は本来遺伝子を等分することを目的とし、そのために分裂期という細胞分裂の過程が存在するのであるから、DNAに対する損傷や合成阻害は当然細胞分裂に影響する。低線量による小さな障害でも遺伝子にあたえる影響は本質的に変わりなく、1本のビームがDNA分子に与える影響は既存の遺伝子の構成を変えてしまう。遺伝子やDNAの分子的な損傷を検索するのは現時点でも容易なことではないが、照射された細胞が分裂期に達した場合はDNAの損傷は、染色体異常という可視的な形態変化として顕微鏡下で検出できる。また、一般には10Gy以下の比較的低線量域では、照射された細胞は照射後の初回の第一分裂は達成されるが、その後の分裂では細胞の死が全体として不均一に細胞集団に起こる。これを分裂死または遺伝的死と呼ぶ。一方、10Gy以上の線量を浴びると細胞はしばしば分裂をしないまま死に至る場合が多くなる。このような細胞死を間期死とよぶが、中には分裂をしないまま生存を続け細胞が次第に巨大化して来る場合もある。このような場合はもう増殖しないことから増殖死と呼んでいる。最近、胸腺細胞のような放射線感受性の高い細胞群で低線量でも起こる間期死は、いわゆるアポトーシスと云われる細胞の自爆死であることが知られ盛んに研究されているが、腸管の上皮細胞やいろいろの細胞で放射線によってアポトーシスが誘導されことが知られている。アポトーシスは致命傷を負った組織細胞が自ら死へ向かう現象としてDNAの変化や遺伝子の作用が盛んに研究されている。 3.放射線の細胞分裂に与える影響 (1) 細胞分裂遅延:細胞を比較的低線量の放射線で照射すると細胞周期の進行に異常を生じ、結果として細胞周期が長くなるために最終段階で起こる細胞分裂の開始が正常より遅れてしまう。細胞周期における細胞の進行阻害は放射線の種類によって異なり、紫外線ではS期が延長するが、X線などイオン化放射線ではS期よりもG2期にはっきりした延長が観察される。これらの細胞周期進行阻害は必然的に細胞を阻害地点に停滞させる。そのためG2期が延長してそこに細胞が停滞する場合これをG2ブロック、またG1期が延長してそこに細胞が停滞した場合をG1ブロックと称して、それぞれ放射線効果の特徴とみなす場合もある。これらの現象を一般に分裂遅延と呼んでおり、遅延の度合いは照射線量に依存して直線的な比例増加を示す( 図3 参照)。また、この遅延は可逆的でもあるので低線量域では早期の細胞死は起こらないため、これが細胞の障害回復反応とみなす考えもある。しかし、高線量域では可逆性を失って分裂期に到達しない内に死を起こす(間期死)細胞が多くなるため、遅れて分裂が起こる細胞の頻度は少なくなり照射線量がさらに増加すると最終的にすべての細胞で分裂は起こらなくなる。すなわち線量の増加にしたがって細胞集団の増殖率は低下してゼロとなった後、細胞致死率が増殖率を上回ると細胞集団は衰退して消滅する。ガン細胞のように生体内で増殖する細胞集団に対する放射線の効果を知る手掛かりとして、細胞の分裂遅延、すなわち細胞集団における増殖遅延増加に関する線量効果を調べる方法が使われる。つまり、細胞分裂阻害による細胞増殖遅延は培養実験系でも生体実験系でも細胞に対する放射線の効果を推定するのに有効な観察指標になっている。 (2) 分裂停止による細胞の巨大化:培養細胞実験系では、照射後細胞が分裂を停止したまま細胞質および細胞核がともに肥大して細胞が巨大化する現象がしばしば観察される。しかし、細胞は早期に死ぬわけでなく生存し続けるが、細胞分裂による増殖は起こらない。このように増殖を停止した状態を保つことを増殖能が失われたという意味で細胞の増殖死と定義されている。この現象も線量依存性であるが、基本的には細胞がM期に進行しないことによって起こると考えられる。しかし、この場合細胞はM期を飛び越して次の細胞周期に入り、DNA合成によってDNA量の倍加を達成して、再びM期をスキップして細胞周期を繰り返すため、細胞核のDNA量は倍数化して肥大する。このような巨大細胞は次第に正しい細胞質と核の容積比率が異常となって生存不能にいたると考えられている。 (3) 不完全な分裂による細胞の多核化:この現象は、細胞の有糸分裂過程の最終段階で核の分裂が終了した後引き続いて起こる細胞質分裂が阻害されることによって起こる。また、有糸分裂過程で放射線によって核の分裂に異常が生じ、核が2ケ以上に分裂する場合もあるが、この時も細胞質分裂が阻害されると多核化を生じる。一般に多核化は分裂装置(中心体形成、紡錘体または紡錘糸形成、動原体形成、など)の異常や細胞質分裂における細胞膜形成阻害などによるもので、放射線による生体分子合成阻害に起因すると考えられるが、その生化学的検索や分子生物学的研究は充分に進んでいない。 (4) 染色体異常による異常分裂と小核形成:放射線による染色体異常の形成は別項目に記載されているが、分裂期に生じる染色体異常はしばしば染色体不分離や脱落を惹き起こす。放射線によって誘導される2動原体染色体はその構造上有糸分裂後期で分離が出来ないためブリッジ形成がおこり、最終的には不等分裂を起こす。また、放射線によって切断された染色体の断片は動原体を失うため有糸分裂過程で取り残されて小核を形成することがある。これらの現象は古くから研究者の目に止まり、放射線の細胞分裂に対する影響として重要な観察指標になっていた。これらの染色体形成関連の異常は線量依存性の効果であり、比較的容易に観察できる。近年、2核細胞形成率の研究にはサイトカラシンBが利用されるようになってその定量的な観察が可能になった。 (5) 間期死とアポトーシス:放射線による細胞致死効果で、胸腺細胞のような非常に感受性の高い細胞集団、または通常15Gy以上の高線量域の照射を受けた細胞において観察される現象で細胞は照射後分裂することなく致死に至る。放射線ばかりでなく他の原因でも致死障害をうけた細胞に起こる死は病理学的に広く理解されている壊死が誘導されていると理解されていた。しかし、1970年代に至って腸管細胞の死がいわゆるアポトーシスであることが観察され、胸腺細胞のような放射線感受性の高い細胞集団では細胞が壊死よりもアポトーシスの過程を経て死を起こすことが明らかになった。アポトーシスは形態的には壊死が核凝縮を起こすのに対して、細胞核が分断されてその断片化を細胞に惹きおこす。また、DNAを検索するといわゆるラダーを起こし、核の断片化の生化学的裏付けとなっていることも観察できる。アポトーシスを起こす細胞では細胞を死に導くタンパク質の合成がメッセンジャーRNAを通じて誘導されることも知られていることから、細胞の自爆死、またはプログラム死とも云われる。この現象は近年、高等動物の発生過程や生体組織の障害過程などで幅広く知られるようになり、アポトーシスに関連する遺伝子活性や酵素反応がいろいろ研究されるようになった。また、細胞学、組織学などの分野で種々の検出方法が提出され利用されているので、従来の細胞効果に関する観察指標と同様に放射線の細胞に対する影響を調べる有効な研究手段になっている。したがって、現在では放射線の細胞に対する影響研究でもin vitoro、in vivoを問わず放射線によるアポトーシスが細胞学から分子生物学にいたるまで幅広く研究が展開されている。 4.細胞放射線感受性の細胞周期依存性 放射線を照射された培養細胞のコロニー形成能(細胞の分裂増殖能)や突然変異誘発能から調べた細胞の放射線感受性は細胞が細胞周期のどの段階で照射されたかに依存し、その変動は放射線の種類によって異なる。多くの場合紫外線とイオン化放射線の効果は互いに鏡像関係にある。放射線感受性の細胞周期依存性を調べるには、細胞を周期内のある時期(位相)に同調させて調べる。 図4 は、分裂期細胞のみを集めて同調培養を行い、時間の経過に従って細胞周期を同調して移動する細胞に照射を行ってその致死感受性を調べた結果である。上図(a)は比較的G1期の短いチャイニーズハムスター細胞による結果で、S期における感受性が紫外線とX線では互いに鏡像関係にあることを示している。下図(b)はG1期が充分長いヒト子宮ガン由来のヒーラ細胞における細胞周期内致死感受性変動を示す。どちらの細胞もS期後半に高い生残率を示すことからDNA合成期の直前は感受性が高く、DNA合成の開始とともに細胞は放射線に耐性となって行くことが分かる。これに対してG1期の長いヒーラ細胞では分裂期に高い感受性を示すが、細胞がG1期を進行するとともにその期の半ばでS期同様に細胞は放射線耐性になることを示している。この2つの耐性ピークと感受性の谷間の時期間の感受性の差は少なくとも数倍の違いを示している。 図5 は、X線照射による細胞突然変異誘発頻度の細胞周期内変動を示す。ここでは、X線による突然変異誘発頻度の変動は細胞致死率の変動とほぼ鏡像関係にあることが注目される。このような細胞放射線感受性の変動に関する知見はガンの放射線治療を有効に行うための重要な基礎研究資料となっているが、このような感受性変動がどのような機構により起こるのかは現在でも解明されていない。放射線の生体物質、とくに核酸およびタンパク質に対する作用は生化学的には研究が進んでいるものの、その分子生物学的詳細は未だ不明のままである。しかし、細胞感受性の変動は明らかに細胞周期依存性を示していることは明らかである。今後はこの相関関係の解明が進むことが望まれる。 <図/表> 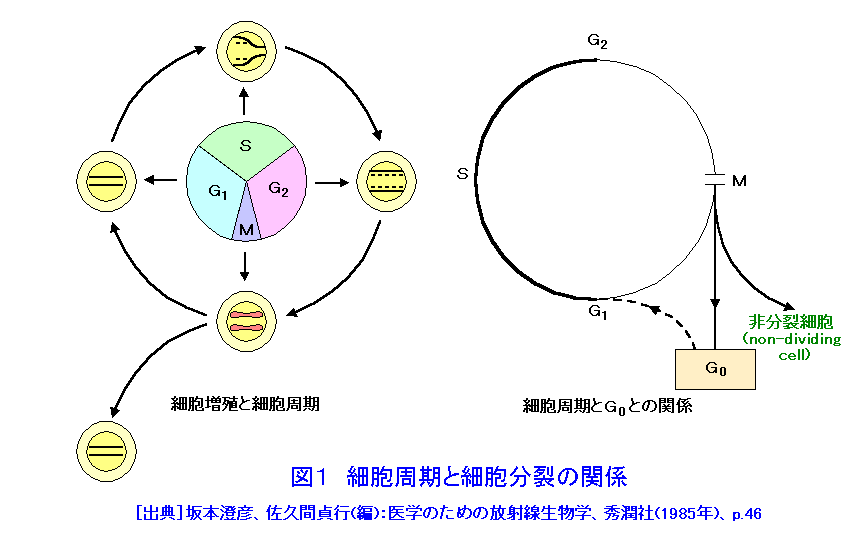
<関連タイトル> 細胞の構成 (09-02-02-01) 放射線の細胞への影響 (09-02-02-07) 被ばく線量と生物学的効果 (09-02-02-13) <参考文献> (1)坂本澄彦、佐久間貞行(編):医学のための放射線生物学、秀潤社(1985年) (2)岡田善雄(編):岩波講座−分子生物学4、細胞の増え方、岩波書店(1992年) (3)J.キーファー(著):放射線生物学、シュプリンガー・フェアラーク東京(1994年)
|

