|
<解説記事ダウンロード>
<概要>
放射線の生物影響には、生体の生理的状況を変化させる作用もあるが、逆に生体の生理状態によって放射線の効果が著しく変動することも最近明らかされて来たが、そのメカニズムはまだ解明されていない。その中に、ホルモンの分泌状態に依存して放射線感受性(発がん効果や細胞代謝活性障害)が増強するという報告がある。また、生物効果として起こる放射線障害が生理条件によって防護される可能性もある。さらに、外界からある種のストレスをかけると放射線影響が低減される場合もある。食餌制限によって放射線誘発白血病の発症が抑制されることも明らかにされた。がん細胞には温熱処理を併用することによって放射線治療効果を促進させる治療はすでに実践されている。これらはすべて生物側の生理学的条件に依存する放射線の生物学的効果の修飾と考えられる。 <更新年月> 2004年02月
<本文>
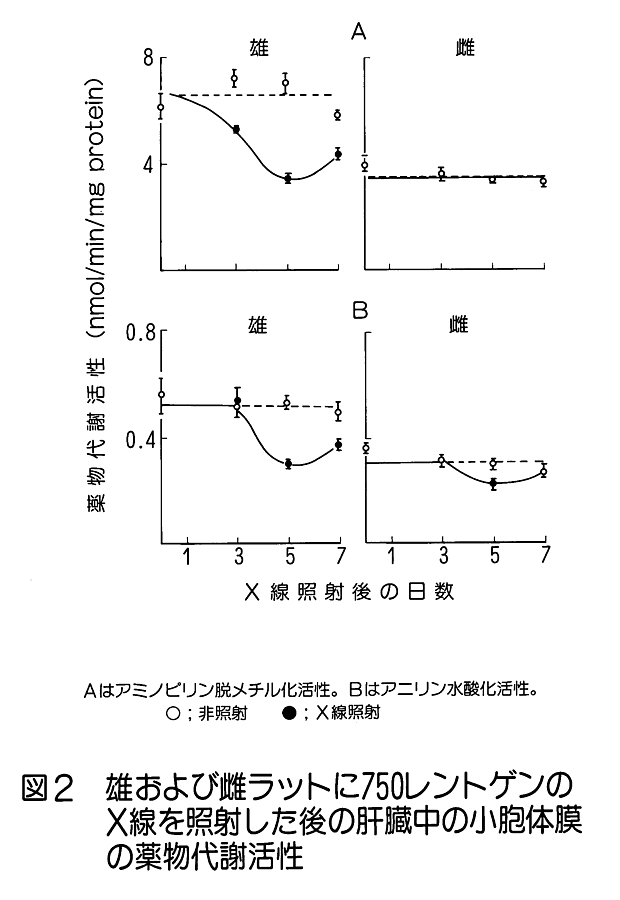
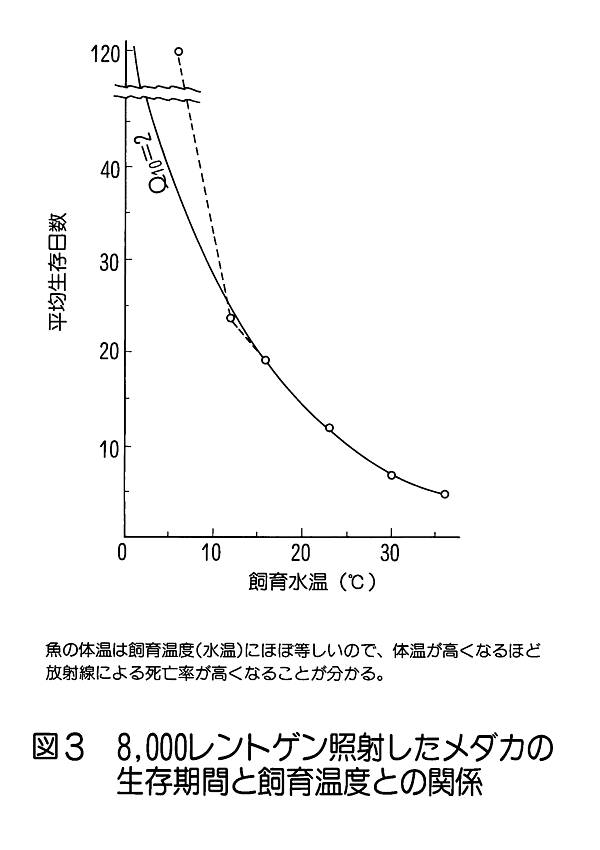
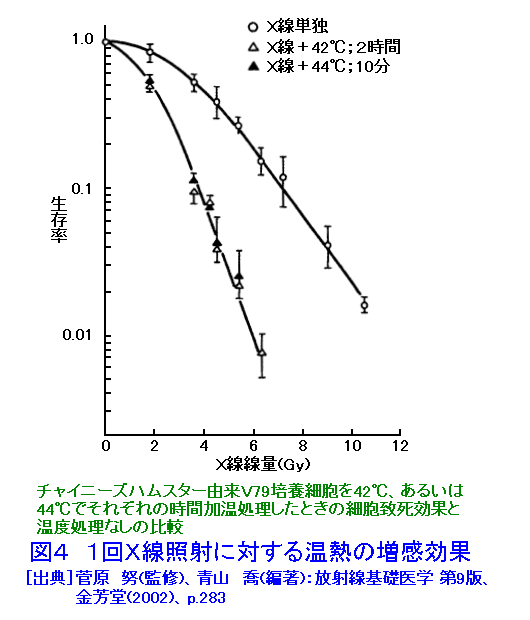
1.放射線生物効果のホルモンによる影響 (1)ホルモンによる放射線誘発乳腺腫瘍発生率の変動。 乳腺などの組織細胞の増殖や機能分化は、主に下垂体や卵巣から分泌されるホルモンの作用により調節されている。さらに、性周期、妊娠、出産、授乳など時期にはそれぞれその機能に応じて特異的なホルモンが分泌され、機能細胞のDNA合成や蛋白質合成の制御に直接関与していることが知られている。特に、乳腺のようなホルモン分泌が機能的に顕著に変動する組織では放射線誘発乳腺腫瘍の発生頻度がホルモン分泌による組織細胞の生理状態によって異なることが知られている。 未成熟のラット(離乳直後で24日令)に コバルト・ガンマ線を2.6Gy全身照射(線量率=14cGy/分)した後、2.5ヶ月令から合成女性ホルモン(diethyl−stilbestrol) を投与すると投与後の一年間に20%のラットに乳腺腫瘍が発生する。一方、成熟した処女ラット(2ヶ月令)を照射した場合は乳腺腫瘍の発生率は22.7%で腺がん併発例を含み、経産ラット(270日令)を照射した場合は74.1%と発生率がきわめて高くなり、腺がんの併発も増加した。このことはホルモン分泌の状態に依存して乳腺腫瘍誘発に関して放射線(発がんイニシエーター)の作用が異なることを示している。 更に、成熟雌ラットの性周期(4−5日)を発情前期、発情期、発情後期、発情間期の4期にわけてそれぞれの時期に全身照射と女性ホルモン投与をすると、発情間期及び発情前期に照射されたラットは高率で乳腺腫瘍が発生し、発情期には発生率が最低であった(図1)。 (2) 肝細胞小胞体酵素活性の性差(ホルモン)による放射線感受性の変動 肝臓の小胞体膜には、体外から入る種々の毒物、薬物等、生体に有毒な低分子物質を代謝して無毒化する薬物代謝酵素系がある。動物を放射線照射すると、この系が失活するが、その機構は小胞体膜の脂質が過酸化されることによりこの系の酵素であるチトクローム450Pが失活するためである。 そこで、2種の薬物を用いて肝臓小胞体膜の代謝活性を測定すると、雄ではX線照射によって活性が3−5時間後に著しく低下する。ところが、この活性低下は雌ではほとんど生じない(図2)。 このことから、放射線による肝臓細胞の薬物代謝酵素系の活性低下も性差(ホルモン)による生理的な状態に依存していると見られる。ただし、ホルモンを介する損傷のみではなく、直接放射線が小胞体膜の損傷を引き起こして生体内に生ずるフリーラジカルが作用する部分もある。この効果はホルモン作用の中枢である頭部照射のみでも誘発されるのでホルモンの関与が強く示唆されている。 2.温度による放射線感受性の変動 一般に高温よりも低温にある方が動物の放射線感受性は低いと言われている。例えば、メダカやキンギョは変温動物であるから飼育温度により体温は変わる。低温下では腸上皮細胞の増殖期における細胞周期も分化後の細胞寿命も共に伸びる。4℃の温度では腸上皮の機能細胞交代はほとんど起こらないので、たとえ4〜8KRの放射線照射をしても腸死は1年以上起こらない。しかし水温25℃では約10日、37℃では3.5日で腸死が起こる(図3)。これは温度による生理的状態が異なるためと考えられ、細胞分裂が低温下では抑制されて放射線障害が発現しない為である。 同様な知見は、体温が低下して代謝活性が下がっている冬眠中の動物でも放射線による致死率が低下すると言われている。細胞レベルでは、通常の培養細胞でも低温条件下で照射すると放射線感受性は低下する。これは代謝活性の低下により障害分子の代謝が進まず、障害が発現しないためと考えられる。これに対して高温域(42−44℃)では細胞の放射線致死感受性が増強される(図4)。この感受性増強効果を温熱効果と呼び、放射線と併用してがん治療に応用されている。この増感機構の一つとしては放射線による障害の回復が阻害されるためであることが明らかになった。 3.マウスの食餌(カロリー)制限による放射線抵抗性の増強 動物実験で発がん率と食餌制限との関連は古くから調べられており、食餌制限によって乳がん、肺腫瘍、白血病、皮膚がん等が有意に減少することが報告されている。しかし、放射線による発がん率の食餌制限による変動は、食餌制限を与えたマウスの放射線照射実験から骨髄性白血病の発症率が抑制されることが明らかになった(図5)。 食餌制限(カロリー制限)は実験マウスが正常に発育できる範囲内に留め、マウス(10週令)に3GyのX線を照射すると、通常食のマウス群では照射後300日経過から白血病が出現するが、照射後食餌制限を施した実験マウス群では500日経過から、また、離乳期からすべて食餌制限にした実験マウス群では700日位経過から白血病が出現した。しかもその出現率は通常食群に比べて有意に低かった。この結果も食餌制限による生理的条件が放射線感受性に影響していると考えられる。この機構はまだ明らかにされていない。 4.漢方薬抽出物、ストレス等による抵抗性の増強例 カドミウムやマンガン等の金属、OK432などの免疫増強剤や漢方薬抽出物の投与、更に、皮膚剥離などによるストレスに対する処理をすることにより著しい放射線抵抗性がみられる。この効果も何らかの生理的変動が結果的に放射線抵抗性を導いたと考えられる(図6)。これらの処理に共通して観察される現象の一つは、肝臓のメタロチオネイン量が増加することがあげられる。メタロチオネインは亜鉛など金属を取り込む性質をもつタンパク質だが、これらの処理によりその肝含有度は1日後に数倍から20倍の濃度になる。メタロチオネインは放射線により生体内に生じる種々のフリーラジカルを消去する物質であるから、肝臓のメタロチオネイン増加は放射線防護に大きく働くと考えられる。また、他の研究ではメタロチオネインがグルタチオンペルオキシダーゼと共に生体中に生じた過酸化物を除去する役割があることも知られているので、照射によって産生されるフリーラジカルの反応産物を消去して障害の防護に働くことが可能である。また、免疫系細胞を刺激するという報告もある。しかし、上記の種々の処理やストレスにより、他の代謝系の変動やいわゆるストレス蛋白の合成なども同時に誘導されることも知られているので、メタロチオネインだけで放射線感受性の低下が説明されるものではない。薬剤等の導入によって誘導される放射線感受性の変動に関する作用機構については今後の研究の進展が待たれる。 5.その他 生理学的条件が変わることによる放射線の生物効果の変動は他にいくつかの条件が知られている。例えば、乾燥状態(胞子や乾燥卵などで放射線抵抗性となる)、種および系統、細胞環境におけるpH濃度などが知られている。 <図/表> 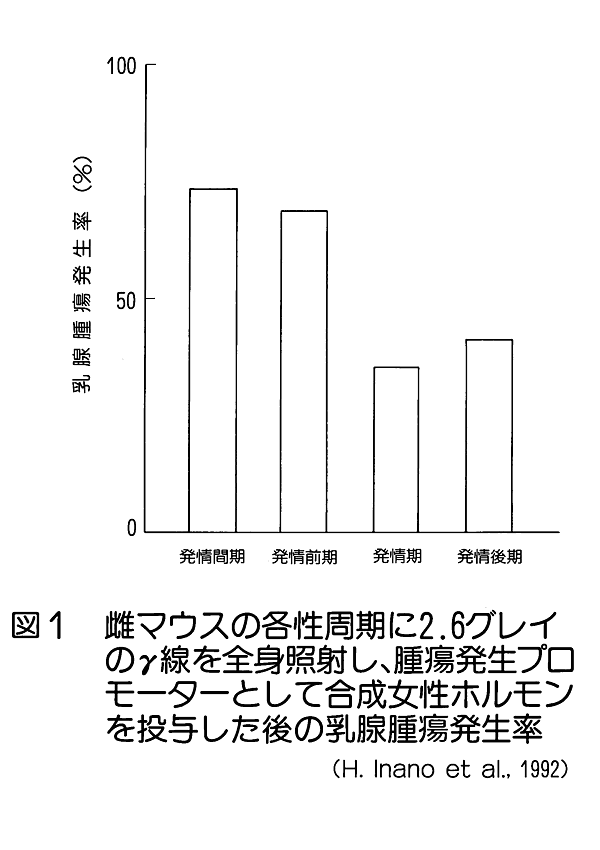
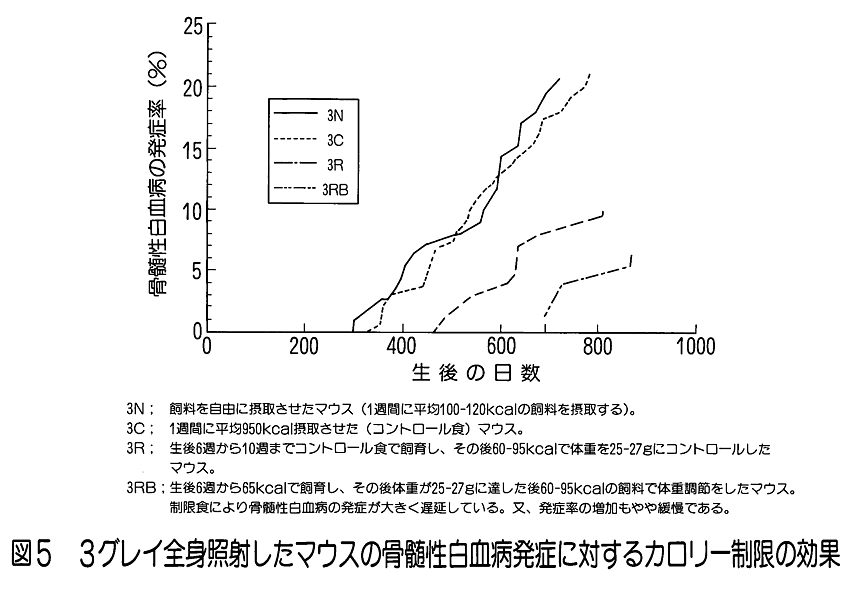
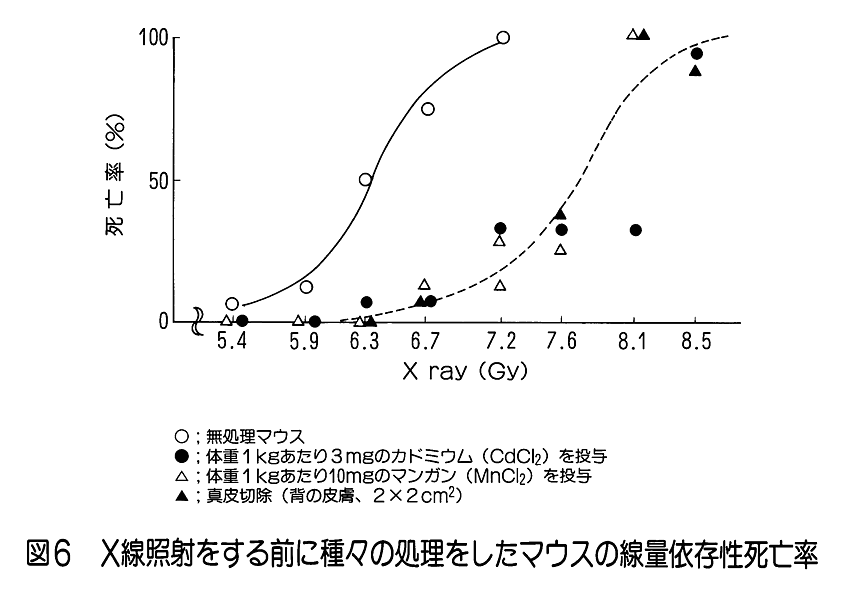
<関連タイトル> 放射線のDNAへの影響 (09-02-02-06) 放射線の細胞への影響 (09-02-02-07) 放射線の細胞系への影響 (09-02-02-08) 放射線効果と修復作用 (09-02-02-12) 被ばく線量と生物学的効果 (09-02-02-13) 放射線生物効果の年齢依存 (09-02-02-18) 放射線生物効果の年齢依存 (09-02-02-18) 放射線の急性影響 (09-02-03-01) 放射線の晩発性影響 (09-02-03-02) <参考文献> (1)稲野 宏志:内分泌環境と放射線誘発乳腺腫瘍、放医研シンポシリーズNo.23(1992) (2)Inano, H., et al.:Influence of the estrous cycle at gamma-ray exposure on radiation. -induced mammary tumorigenesis in virgin rats. Int. J. Cancer 52,1992. (3)伊藤 明弘:放射線誘発マウス肝腫瘍の発現に関与する生体要因について、放医研シンポシリーズNo.23,(1992) (4)Nair, V., et al.:Effects of prenatal X-irradiation:Sutdies on the mechanism of X-irradiation -induced inhibition of microsomal enzyme development in ratliver, Radiat. Res.,36,(1968) (5)Knott,J. C. A. and Wills,E. D. : Effects of whole-body irradiation and hormones on drug metabolism in the liver endoplasmic reticulum,Radiat. Res.,53,65-76,(1973) (6)Nakazawa,T.,et al. :Effects of X-irradiation on drug-metabolizing enzyme systems in liver microsomes of male and female rats,Radiat. Res.,66,1976. (7)Etoh,H. and Egami,N. : Effect of temperature on survival period of the fish,Oryzias latipes,following irradiation with different X-ray doses. Annot. Zool Japon.,38,114-121,(1965) (8)江藤 久美:個体・組織に対する放射線影響、メダカの生物学(江上信雄、山上健次郎、嶋昭紘(編))、東京大学出版会(1990)、p.219-233 (9)菅原 努(監修)、青山 喬(編著):放射線基礎医学 第9版、金芳堂(2002年4月)、p.282-283
|

