|
<解説記事ダウンロード>
<概要>
密封小線源(60Co、137Cs、198Au、192Ir、125I)及び非密封線源(89Sr、90Y、131I)を利用する内部放射線療法について概説する。密封小線源のガンマ線照射は、線源をがん組織の中や近傍に置いて照射する線量集中性と時間的線量分布に優れた治療法である。一方、施術者の被ばくは大きな問題であり様々な対策が採られている。高線量率線源(12Gy/時間以上)は、子宮頚がん、子宮体がん、胃がん、肺がん等の腔内照射や前立腺等の組織内照射に利用され、施術者の放射線被ばくを低減するためRALS(高線量率小線源治療装置)の利用が普及している。低線量率線源(2Gy/時間以下)を用いる口腔、舌、乳房等の組織内照射や表面照射の際には、RALSを利用できないと施術者の被ばくは比較的高くなる。子宮頸がんと前立腺がんが密封線源利用の代表的な適応症である。非密封線源のベータ線は、RIを静脈注射や服用で体内に摂取する。甲状腺がん、多発骨転移、褐色細胞腫等の内照射治療に利用されている。日本で保険収載されている非密封線源は89Sr、90Y、131Iの三種類である。 <更新年月> 2015年11月
<本文>
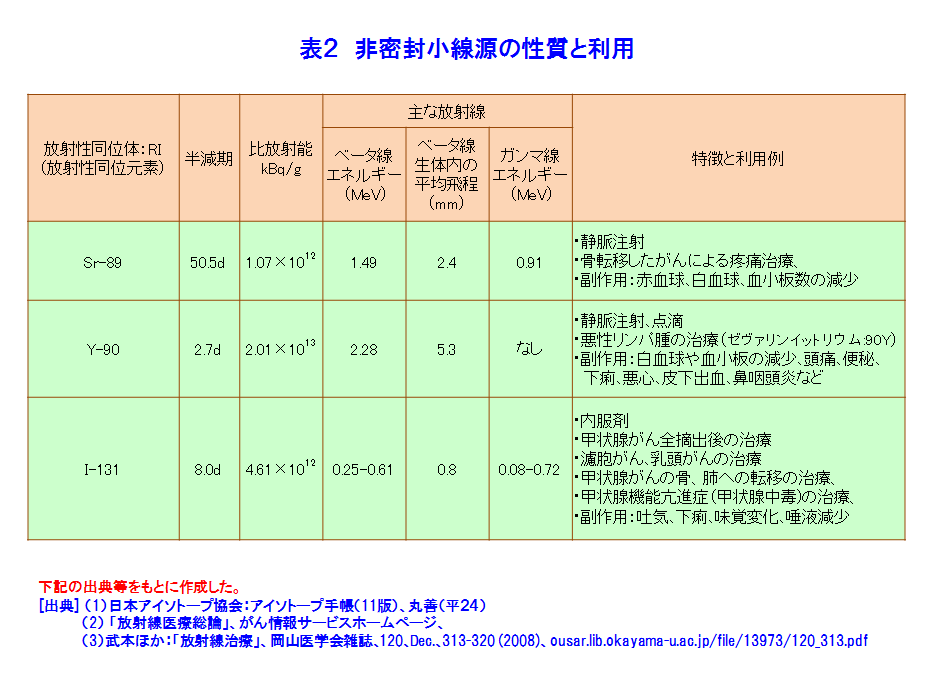
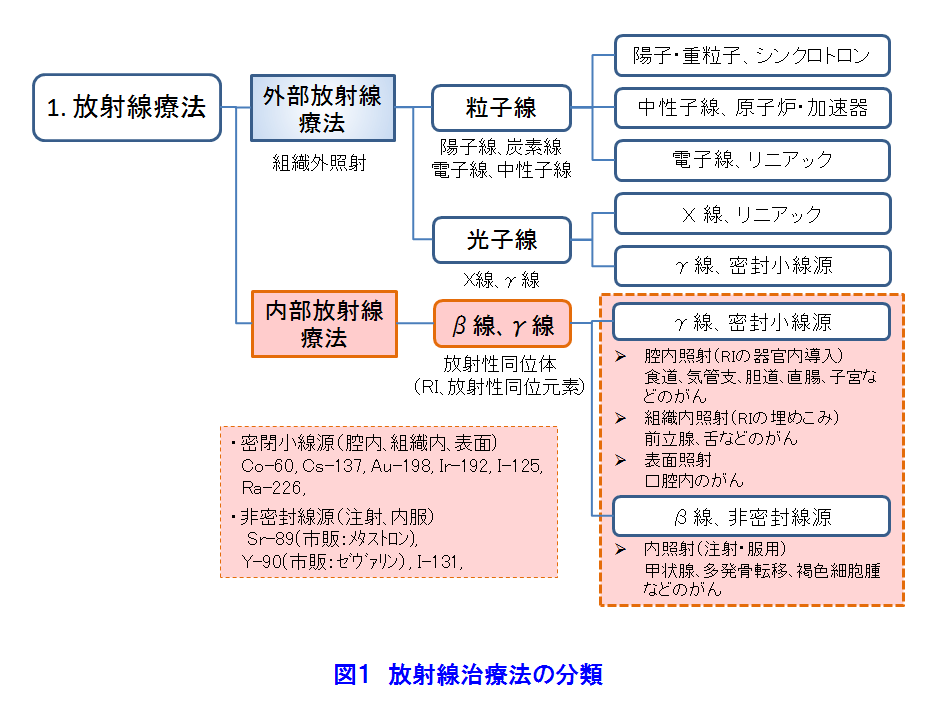
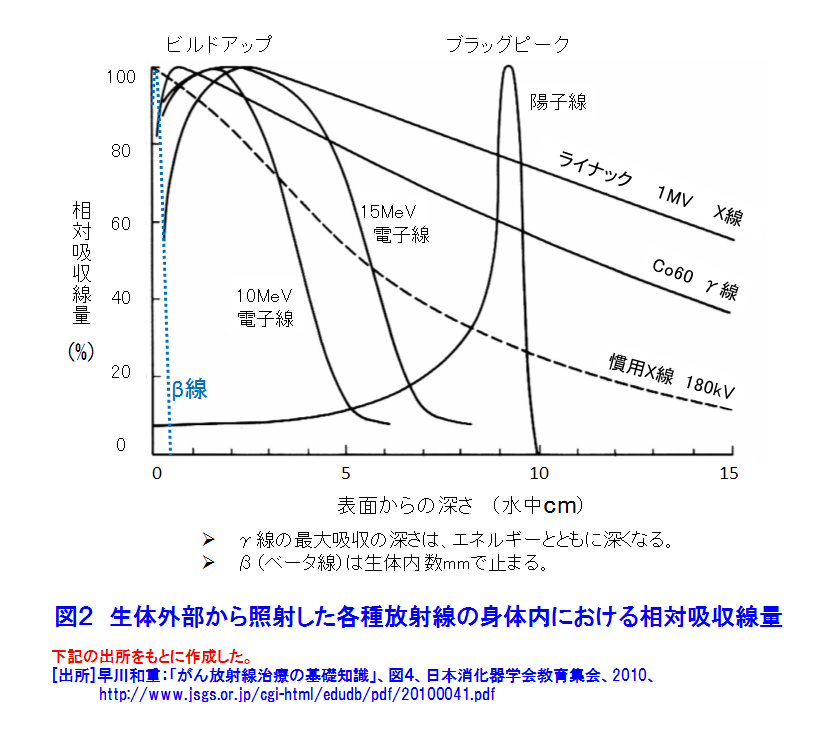
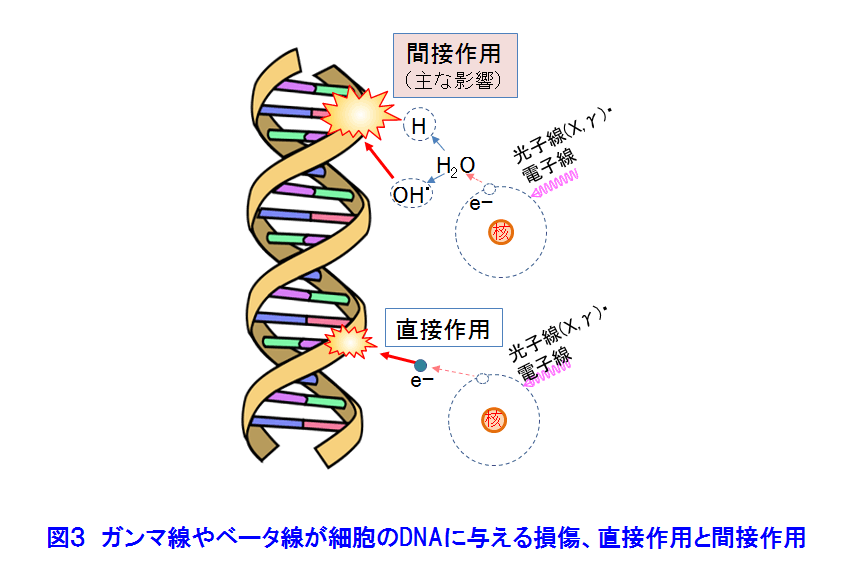
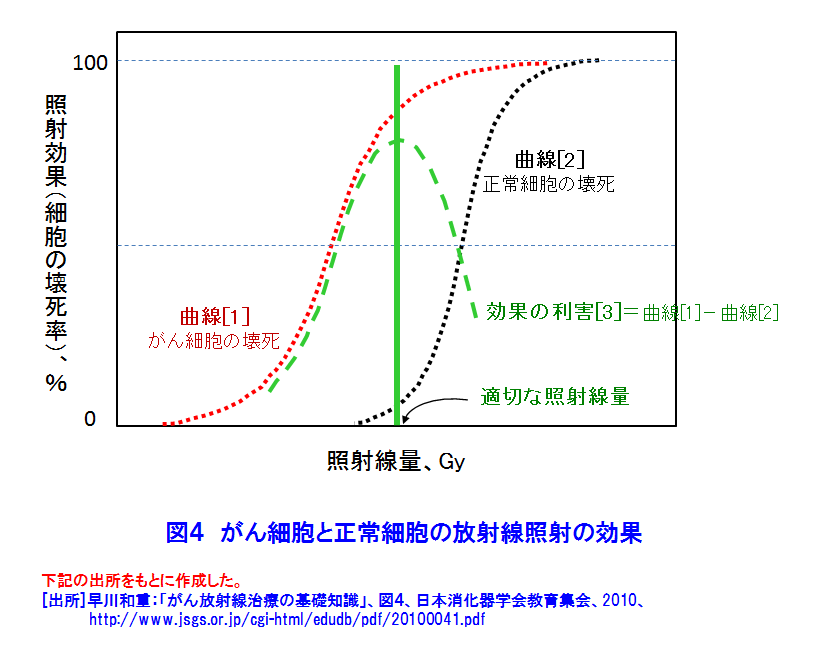
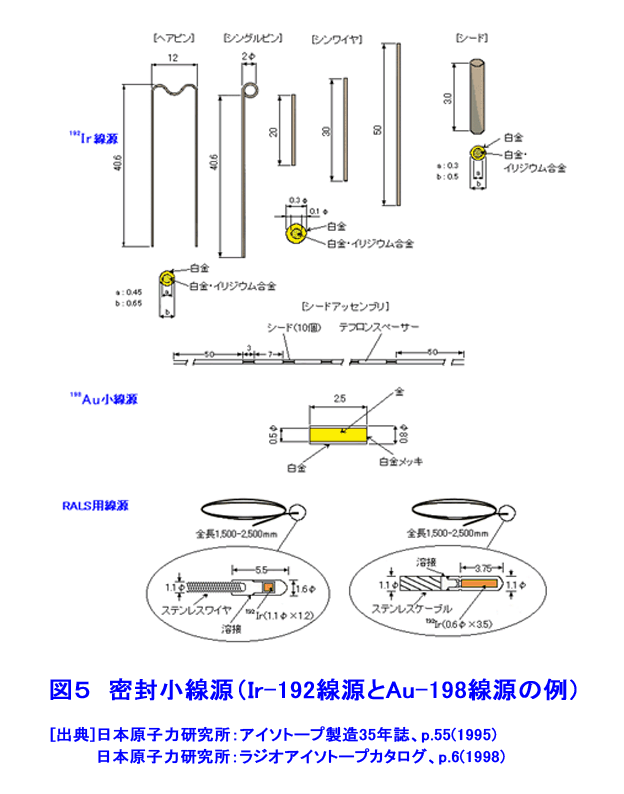
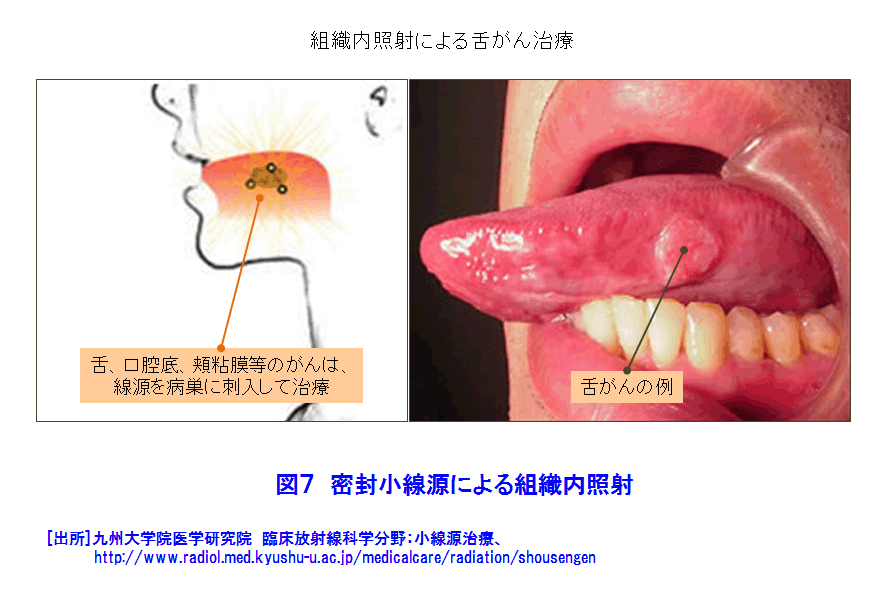
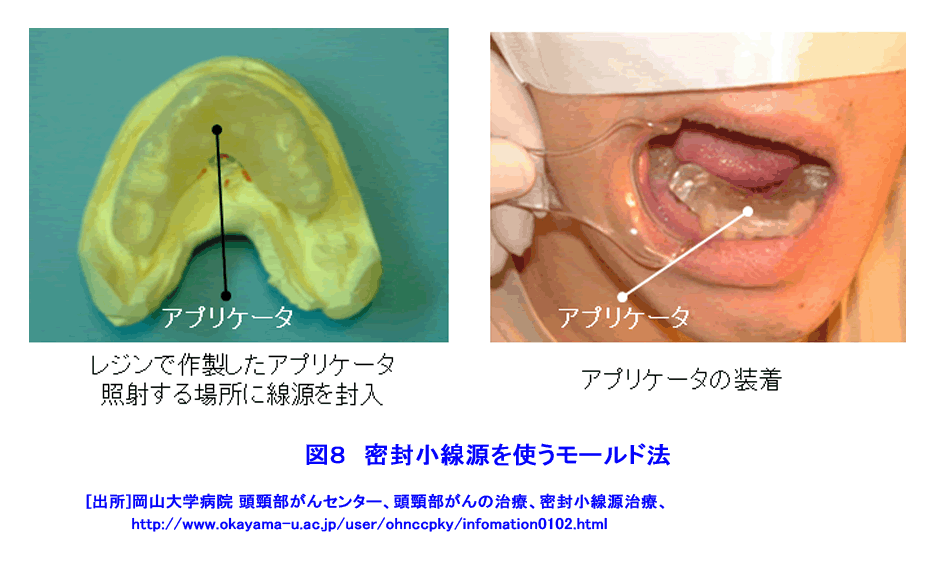
1.がんの放射線治療の原理 1.1 放射線治療の概観 1981年以降、がんは日本人の第1死因である。そこで、1984年以来がん治療は国の健康管理の重要な課題となりその研究開発と医療の充実が図られている。がんの放射線治療は、1895年のレントゲンによるX線の発見の翌年から始まっている。日本では、1901年にがんのX線治療の研究が始まり、1960年頃から九州大学でベータトロンのX線を利用する治療法が研究された。その後、光子線(X線、γ線)利用はがんの放射線治療の主流である。放射線治療には、がんの根治、小さな患者負担、短い治療時間、小さい形態・機能変化、小さい生活の変化等の長所があるが、日本では放射線に対する忌避感が強いためか利用率は欧米の半分である。 がんの放射線治療法は、図1のように大別できる。治療の主流は光子線利用である。治療法は、放射線源を体外に置く外部放射線療法と体内に入れる内部放射線療法に大別できる。ここでは、密封小線源のガンマ線の利用する腔内照射、組織内照射及び表面照射と、非密封線源のベータ線を利用する内照射について述べる。 1.2 ガンマ線とベータ線による放射線治療の原理 (1)放射線の透過力で体内のがん細胞を照射する 図2は、身体が放射線照射された際の照射面からの深さと、身体内での放射線の相対吸収線量の関係を示す。ガンマ(γ)線は身体表面近くで多くが吸収されるが、ガンマ線の進行方向の正常組織の被ばく低減に工夫が必要である。ベータ(β)線は身体表面から数mmで止まる。 (2)放射線の間接作用でがん細胞は死滅する 図3は、X線、γ線及びβ線がDNAに与える直接作用と間接作用を示す。直接作用では、放射線は衝突した原子を電離し、弾き出された高エネルギーの電離電子がDNAを損壊し、DNAの二重鎖切断などにより細胞は死滅する。間接作用では電離電子が生体内の水を電離して有害なラジカル(OH・/small>)を生じ、このラジカルがDNAを間接的に損壊し死滅させる。間接作用の割合は直接作用の約三倍である。 (3)分割照射でがんを根治する 図4は、照射線量とがん細胞と正常細胞の死滅率の関連を模式的に示す。がん細胞の放射線抵抗力は低いので、照射線量に対し曲線[1]の様な照射効果がある。一方、正常細胞は比較的高い放射線抵抗力があるので曲線[2]のようになる。曲線[1]と[2]から、照射の利害曲線[3]が得られ、治療に適切な照射線量が判る。一方、正常細胞はがん細胞より高い回復力があるので、その回復力を考慮した時間間隔で照射治療を繰り返す分割照射によりがんを根治できる。 分割照射の間にがんが縮小して酸素が供給され易くなると、がんの放射線感受性が高くなる再酸素化が起き、がん細胞の死滅が更に増え、合わせて正常細胞の回復が進む。放射線源の永久刺入による治療に効果的である。 2.密封小線源療法 密封RI(放射性同位体)のγ(ガンマ)線を利用する密封小線源治療法と非密封RIのβ(ベータ)線を利用する内照射に分けて述べる。 2.1 放射線源 表1に密封小線源として利用するRIの性質と使用例を示す。図5にRIを封入した様々な形状の密封小線源を示す。 2.2 治療方法 高線量率照射による治療では、線量率12Gy/時間以上の線源で10〜20分間分割照射する。主に放射線照射が効きにくい腫瘍や前立腺がん、頭頸部がん、子宮頸がんの腔内照射で採用される。線源は192Irや60Coである。施術者の放射線被ばくを低減するためRALS(Remote After loading System、高線量率小線源治療装置)が利用される(図6)。線源は、遮蔽用器を兼ねるRALS本体に予め収納されている(図5)。身体の照射位置にアプリケータと称する細管を設置し、その中に線源をRALS本体から繰り出し照射する。 低線量率照射による治療では、線量率2Gy/時間以下の線源で、数日から数か月間の分割照射を行う。RALSを利用しないで線源近傍で施術する施術者の放射線被ばくは避け難い。一時刺入では192Irや137Csが舌癌の治療に用いられ、前立腺がん、口腔がん、中咽頭がん等の治療は125I、198Auが永久刺入に用いられる。 プレローデング(Preloading)による治療では、線源は施術者によって治療部に挿入される。 アフターローデング(After loading)では、RALSの利用が普及している。 2.3 治療例(表1) (1)腔内照射 図6は、RALSと密封小線源を利用する子宮頚がん、前立腺がん等の治療例である。利用するRIは、60Co、192Ir等の70〜400GBqの高線量率照射用線源である(図5)。線源は、がん近傍にアプリケータで導かれて挿入され病巣を照射する。一回の照射時間は数分から十数分である。 (2)組織内照射 125I、198Au等の10〜200MBqの低線量率照射用線源をがん組織にあわせ複数個利用する(図7)。口腔、舌、乳房等のがんでは、がん組織やその周囲組織に挿入される。これらのRIの半減期は比較的短いので、永久刺入し数日の時間をかけて照射する。 (3)表面照射 低線量率線源が口腔底、頬粘膜、硬口蓋、歯肉蓋、歯肉等のがんの治療に用いられる。病変部をかたどりしてレジンで型(アプリケータ)を製作する(図8)。がん組織に近接する所に放射線源を埋め込んだアプリケータを装着し(モールド)、照射治療を行う。アプリケータは必要に応じて取り外しできる。 3.非密封線源の利用、内照射 3.1 内照射とRI(放射性同位体) 非密封のRIによる治療では、RIをがん細胞に取込み、β線照射によりがん細胞を死滅させる。表2は日本で保険承認されている三種類のRIの主な性質や利用例を示す。これらのRIの半減期は数日〜数十日で、比放射能は比較的高い。β線の生体内の飛程は数mmである。治療の際は、これらRIを含む薬剤は服用または静脈注射で体内に摂りこまれ、目的のがん細胞に集積し放射線照射するので、適切なRI薬剤の開発が重要な課題になる。 3.2 RI薬剤 以下の三種類のRIを含む薬剤が販売・利用されている。 (1)ストロンチウム89(89Sr) 89Srはカルシウムと同族(アルカリ土類金属元素)で骨組織に沈着しやすいので、がんの骨転移による疼痛を抑えるのに利用される。静脈注射で摂取された89Srは、活動の活発ながんの骨転移部に集積する。集積しなかった89Srは尿で排泄され、骨以外の組織への集積は1%以下である。天然の88Sr(存在度82.6%)を原子炉照射して88Sr(n、γ)89Sr反応で製造する。 (2)イットリウム90(90Y) 90Yを含む市販薬剤がある。静脈注射で体内に入れられた90Yは、転移によって生じたリンパ腺がん、T細胞白血病、卵巣がん、骨がん等を照射治療できる。90Yはガンマ線を放出しないので周辺組織・器官の放射線被ばくはほぼ無い。天然の89Y(100%)を原子炉照射して製造する。 (3)ヨウ素131(131I) 131Iはウラン235(235U)の核分裂生成物の一つである。一方、ヨウ素は必須微量元素であり、不足すると甲状腺ホルモンが欠乏し甲状腺がんになり易い。甲状腺がんは、131Iの1〜8GBqを内服して治療できる。ほかに、乳頭がん、濾胞がん、甲状腺機能亢進症(甲状腺中毒)の治療に用いられ、甲状腺がんが骨や肺に転移した場合の治療にも利用されている。天然のテルル130(130Te、34%)を原子炉照射して131Teを得る。131Teは半減期25分でベータ壊変して131Iになる。 (前回更新:2005年2月) <図/表> 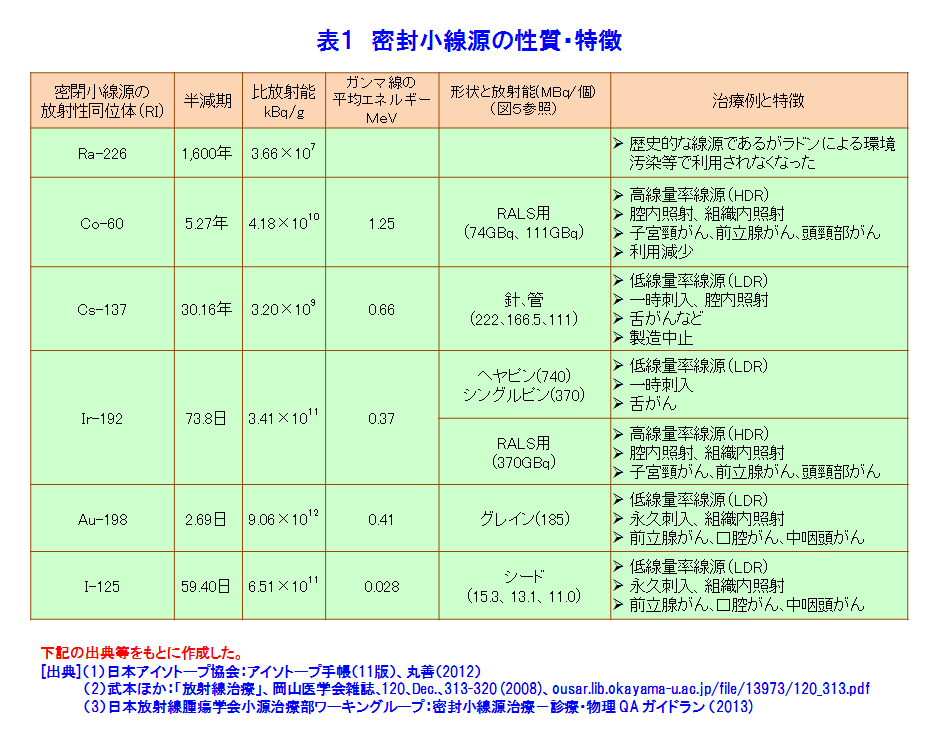

<関連タイトル> 重粒子線照射によるがんの治療 (08-02-02-01) 放射線によるがんの治療(手法と対象) (08-02-02-02) 放射線によるがんの治療(特徴と利点) (08-02-02-03) 高エネルギー加速器の医学での利用(陽子線によるがん治療) (08-02-02-06) RIミサイル療法 (08-02-02-11) 放射線のDNAへの影響 (09-02-02-06) 放射線の細胞への影響 (09-02-02-07) 放射線の直接作用と間接作用 (09-02-02-10) 治療用医療放射線と人体影響 (09-03-04-02) <参考文献> (1)早川和重:「がん放射線治療の基礎知識」、2010年度前期日本消化器外科学会教育集会、http://www.jsgs.or.jp/cgi-html/edudb/pdf/20100041.pdf (2)がん情報サービス:「放射線療法総論」、http://ganjoho.jp/public/dia_tre/treatment/radiotherapy/radiotherapy.html (3)(公社)日本放射線腫瘍学会:「小線源治療の現況と将来」、JASTRO NEWSLETTER,vol.104,No.2,pp.11-22(2012) (4)九州大学院医学研究院 臨床放射線科学分野:小線源治療、http://www.radiol.med.kyushu-u.ac.jp/medicalcare/radiation/shousengen (5)岡山大学病院 頭頸部がんセンター:頭頸部がんの治療、密封小線源治療、http://www.okayama-u.ac.jp/user/ohnccpky/infomation0102.html (6)内山眞幸:「飲んで治す放射線、注射して治す放射線」、東京慈恵医科大学放射線医学講座 (7)東北がんネットワーク:放射線治療専門委員会、特殊放射線治療、http://touhoku-gannet.jp/introduction/index.html (8)武本充広ほか:「放射線治療」、岡山医学会雑誌、120(12)、313-320(2008)、ousar.lib.okayama-u.ac.jp/file/13973/120_313.pdf (9)(一財)放射線利用振興協会:放射線利用技術データベース、No.030056、「密封小線源治療用核種の種類と特徴」(1998)、http://www.rada.or.jp/database/home4/normal/ht-docs/member/synopsis/030056.html (10)日本アイソトープ協会:アイソトープ手帳(11版)、丸善(2012) (11)日本放射線腫瘍学会小源治療部ワーキングループ:密封小線源治療−診療・物理QA ガイドラン−(2013) (12)日本原子力研究所:アイソトープ製造35年誌(1995) (13)日本原子力研究所:ラジオアイソトープカタログ(1998)
|

