|
<解説記事ダウンロード>
<概要>
突然変異育種を取り巻く環境で最も大きな変化はゲノム研究の発展であり、イネの全塩基配列解読以降、これを利用した突然変異体の選抜技術や遺伝子機能解明のための突然変異リソースの作出が大きな課題となっている。このような分子遺伝学的解析によって、「LGC-1」の低グルテリン形質がRNA干渉によることが明らかになった。また、ガンマ線照射によって生じる遺伝子欠失の大きさも明らかになってきた。一方、アジア各国では、放射線育種の有用性が認識され、その推進が加速化されている。 <更新年月> 2007年07月
<本文>
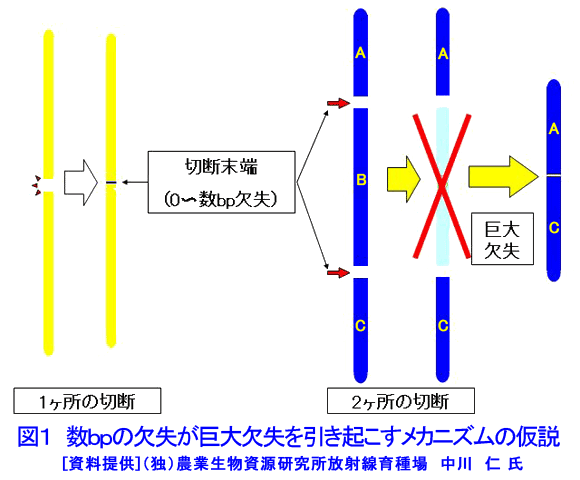
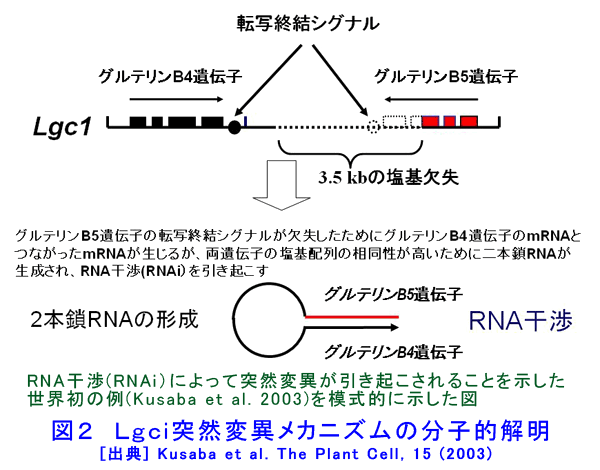
1.変異の方向性(変異の制御)と逆遺伝学的解析 突然変異育種を取り巻く環境で最も大きな変化は急速なゲノム研究の発展であり、特にイネでは2004年に「日本晴」を材料にして全塩基配列が解読された(International Rice Genome Sequence Project,2005;http://www.nias.affrc.go.jp/pressrelease/2005/20050811.html)。これによって、二つのことが突然育種法に関係する大きな課題となった。その一つは特性と配列が明らかになった遺伝子では、この情報を利用した突然変異体の選抜への利用が期待できることである。もう一つは、未知の遺伝子機能や遺伝子解析のために有用な突然変異体リソースを作出することである。 一方、突然変異育種における究極の目標は、方向性を持たせた変異作出である。しかし、突然変異誘発はあらゆる遺伝子座にランダムに起こると推定され、照射技術によってその方向性を制御することは困難である。ところが、遺伝子の塩基配列に関する遺伝情報が存在すれば、多数の突然変異体の中から目的とする遺伝子座に突然変異が生じた個体のみを選抜することが可能になり、方向性を持たせた突然変異誘発と同じ結果をもたらすことができる。これが、突然変異育種における逆遺伝学的解析の利用である。 γ線照射等は遺伝子座に欠失を生じさせることが多い。ここで、スクリーニングする遺伝子に対するプライマーを作成してPCRを行うとこの遺伝子に生じた突然変異体を野生型との比較によって検出することが可能になる。すなわち、野生型と比較してサイズの小さい泳動バンドが増幅されることになり、このバンドの検出によって遺伝子欠失変異体を選抜することができる。PCRは感度の高い技術であるから、数十個体のDNAをバルクにしても検出できるため、各個体のDNAに対して検定する必要はなく、例えば育苗箱の縦の列ごと、および横の列ごとにDNAを混ぜたサンプルの解析を行うことによって効率的な解析も可能である。現在、放射線育種場において、Li et al.(2001)が、シロイヌナズナ(Arabidopsis thaliana)に速中性子を照射して作出した欠失突然変異ライブラリーの突然変異の遺伝子解析のために開発した手法を応用して、イネにおいて同様の解析技術の構築を計っている。 2.突然変異の分子学的解明 (1)欠失の大きさ 放射線にはγ線やX線のような低LET放射線と炭素イオンのような高LET放射線が存在する。Sachs(2000)は、FISH法を用いて低LET放射線と高LET放射線の引き起こす突然変異に関する研究を行い、高LET放射線は複雑な染色体構造の変化を引き起こすが、低LET放射線では、照射量が高い場合にのみ同様の構造変化が見られると報告した。また、放射線育種の黎明期に、Stadler and Roman(1948)は花粉照射法を用いたトウモロコシの突然変異の解析によって、後代に伝達されない多くの突然変異が生じていることを示した。しかし、このことを分子遺伝学的に示した例はなかった。そこで、Naito et al.(2005)は、Stadler and Roman(1948)がトウモロコシの突然変異の解析のために開発した花粉照射法を応用し、低LETのγ線と高LETの炭素イオンをシロイヌナズナの花粉に照射して、両者の引き起こす突然変異の分子遺伝学的調査を行った。この方法の利点は、材料としたシロイヌナズナで全塩基配列が明らかにされ、多くの突然変異リソースが存在すること、また、花粉照射法によって個体レベルで生じた突然変異の場合にM2世代には伝達されないような突然変異の解析を行うことが可能なことである。その結果、150〜600Gyのγ線照射と40〜150Gyの炭素イオンビーム照射のいずれにおいても、その大半が後代に伝達不可能な、最大で6Mbpの巨大欠失を引き起こしていることが明らかとなった(表1)。興味深いことに、同じ照射集団の中に伝達可能な1〜4bpの突然変異体も見出された。この原因として、遺伝子が1か所で切断した後に修復された場合にこのような欠失が生じ、一方、2か所で切断した後に両端が切断した部分が欠失して修復された場合に巨大欠失が生じると推定された(図1)。また、この巨大欠失が伝達されない原因として、巨大欠失中に配偶子発生や生育に不可欠な遺伝子が存在することが示唆された。 (2)RNA干渉 上記低グルテリン品種「LGC1」の低グルテリン形質は優性1遺伝子Lgc1に支配されている。Kusaba et al.(2003)は、この突然変異がRNA干渉によって引き起こされることを明らかにした。すなわち、野生型においてグルテリン蛋白質を作る遺伝子座には互いに塩基配列がよく似たグルテリンB4遺伝子とグルテリンB5遺伝子が一定間隔を置き、逆方向を向いて連なっている。突然変異系統「NM67」ではこの両遺伝子の間の3.5kbの塩基配列が欠失することにより、B5遺伝子の一部と転写終結シグナルを欠いたまま連結した状態になっており、B5遺伝子で転写を終結することができず、その結果両遺伝子がつながったmRNAが形成される。さらにこのmRNAはB4遺伝子とB5遺伝子の間の相同な部分で二重鎖ヘアピン構造を作り、このような二重鎖RNAはmRNAの分解を引き起こし(RNA干渉)、その結果、グルテリン遺伝子の発現が抑制される(図2)。この研究は突然変異形質がRNA干渉によって引き起こされることを示した世界初の報告として、科学雑誌Natureで紹介された(Christopher,2003)。 いくつかの作物でゲノム配列が明らかになったことや、分子レベルで突然変異のメカニズムを解析する分子遺伝学的手法の進歩は、これまでとは違った突然変異の姿を明らかにする可能性も秘めている。また、逆に突然変異から遺伝子の機能を明らかにすることも可能となった。さらに、γ線、X線、イオンビームおよび中性子照射が引き起こす突然変異の相同性や差異も分子学的に徐々に明らかになり、これらすべてを網羅した大きな意味での放射線育種法の構築も重要である。また、放射線育種場においては、γ線急照射(ガンマールーム)と緩照射(ガンマーフィールドとガンマーグリーンハウス)が引き起こす突然変異の違いを明らかにすることも重要である。この際に、遺伝子修復機構が大きく係わっていると推定され、高等植物においてどのような修復機構が存在するかについて、ダイズで明らかとなった放射線感受性の品種間差異(高木、1974)などとからめて明らかにすることも重要である。 3.海外の動向と今後の研究方向 アジア各国では、放射線育種の有用性が認識され、その推進が加速化されている。例えば、韓国において2005年に韓国原子力エネルギー研究所(Korea Atomic Energy Research Institute:KAERI)にAdvanced Radiation Application Research Centerが建設され、2006年に研究活動が開始された。これは農業生物学(Agro-biology)、食料科学、工業、環境および医療分野での放射線利用を推進する総合的研究施設で、γ線、電子線、イオンビーム、サイクロトロン各々の照射が可能で、植物体に対する緩照射が可能なガンマーグリーンハウス、一般温室、試験圃場、種子保存庫および在来植物の植物園が建設されている。 また、マレーシアにおいて、現在、放射線育種場と同様の照射施設を大きくしたものが建設中であり、2007年度中に完成する運びになっている。 現在、FNCA(アジア原子力協力フォーラム)で放射線育種プロジェクト(http://www.fnca.jp/mb/introduction.html)が推進されており、突然変異を利用したダイズとソルガムの耐旱性、ランの耐虫性およびバナナの耐病性突然変異品種育成を目指したプロジェクトが推進されている。 このように、アジア各地ではγ線等の放射線を利用した品種育成が推進されており、これからもイネを中心にして多くの品種が育成されていくと思われる。 <図/表> 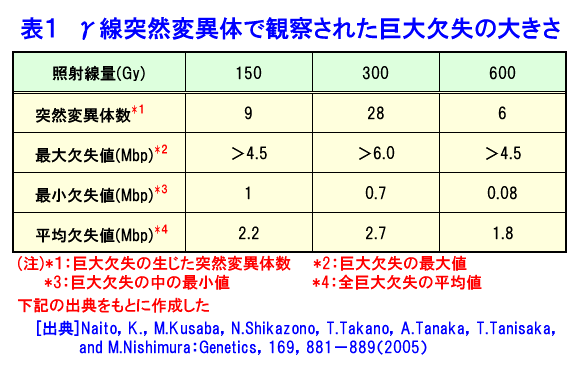
<関連タイトル> 放射線照射による農作物の品種改良(放射線育種) (08-03-01-01) 放射線育種の利用例 (08-03-01-09) 突然変異育種と放射線育種場の成果(1) (08-03-01-11) <参考文献> (1)Christopher,S.:Nature,423,390(2003) (2)International Rice Genome Sequence Project,Nature,436,793-800(2005) (3)Kusaba,M.,K.Miyahara,S.Iida,H.Fukuoka,T.Takano,H.Sassa,M.Nishimura,and T.Nishio:The Plant Cell,15,1455-1467(2003) (4)Li,X.,Y.Song,K.Century,S.Straight,P.Ronald,X.Dong,M.Lassner,and Y.Zhang:The Plant Journal,27(3),235-242(2001) (5)Naito,K.,M.Kusaba,N.Shikazono,T.Takano,A.Tanaka,T.Tanisaka,and M.Nishimura:Genetics,169,881-889(2005) (6)Sachs,R. K.,Hilakey,L. R. And Trask,B. J. Trends Genet. 16,143-146 (2000) (7)Stadler,S. J. and H. Roman:Genetics,33,273-303(1948) (8)高木胖:放射線育種場研究報告、3、45-87(1974)
|

