|
<解説記事ダウンロード>
<概要>
超アクチノイド元素の化学的研究には、新しく発見されてくる未知の元素の化学的性質を調べ、その元素が周期表のどの位置に入るかを確認するという最も基本的な課題とともに、重元素領域での化学結合における相対論的効果の検証という興味深いテーマもある。一方、シングルアトムを対象にした化学分析という従来の化学の概念を超える展開が要求される。周期表上で原子番号の上限に位置する元素の性質はどうなっているのか。核・放射化学あるいは原子力化学のみならず無機化学、分析化学の立場からもきわめて興味ある課題である。ここでは、超アクチノイド元素の化学的研究の特徴と最近の日本原子力研究開発機構(原子力機構)におけるRfの化学的研究ならびにヨーロッパのグループによる108番元素ハッシウム(Hs)の研究成果を中心に紹介する。 <更新年月> 2007年12月
<本文>
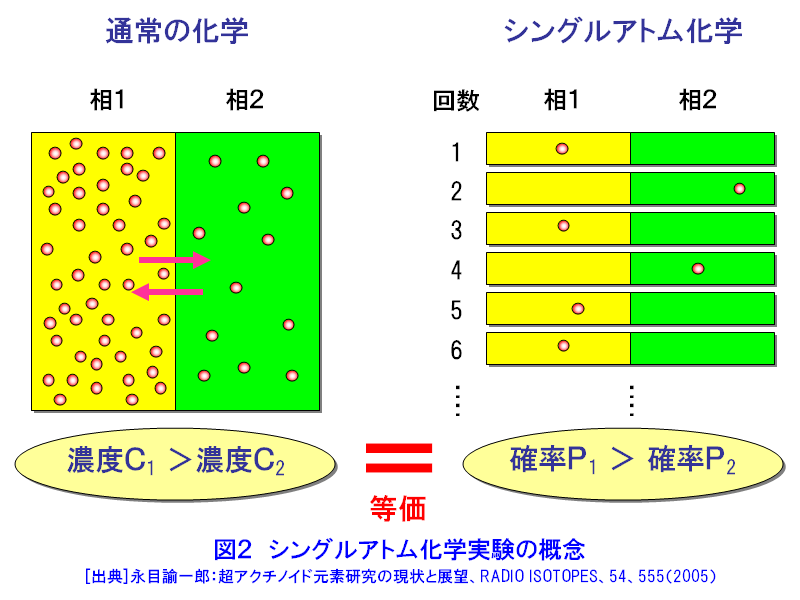
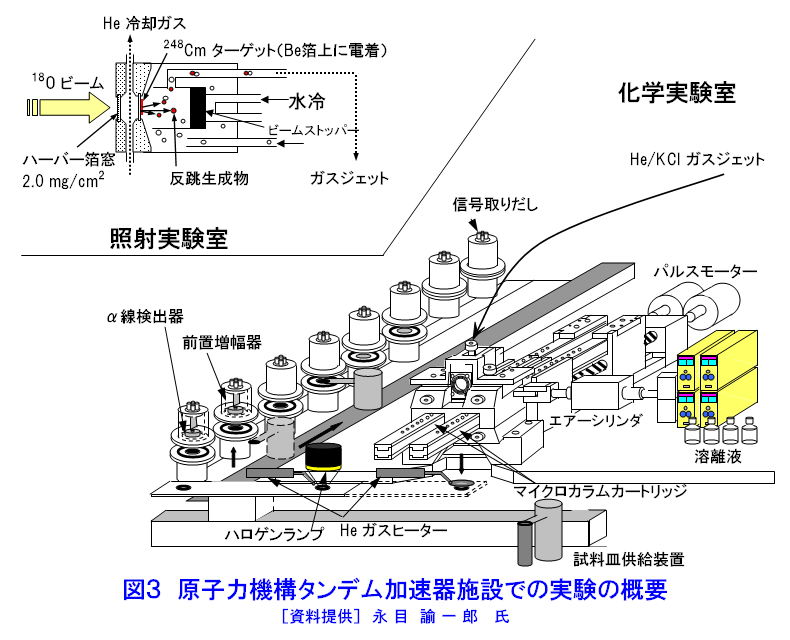
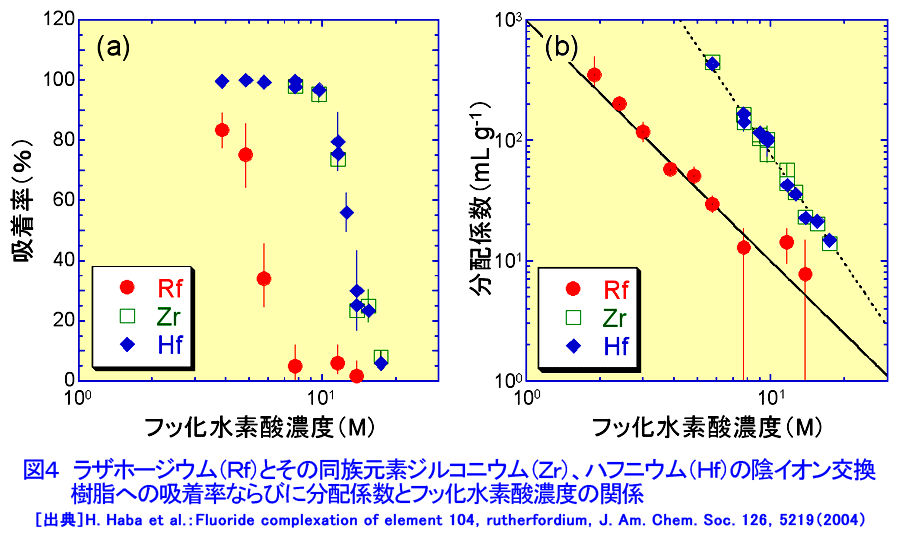
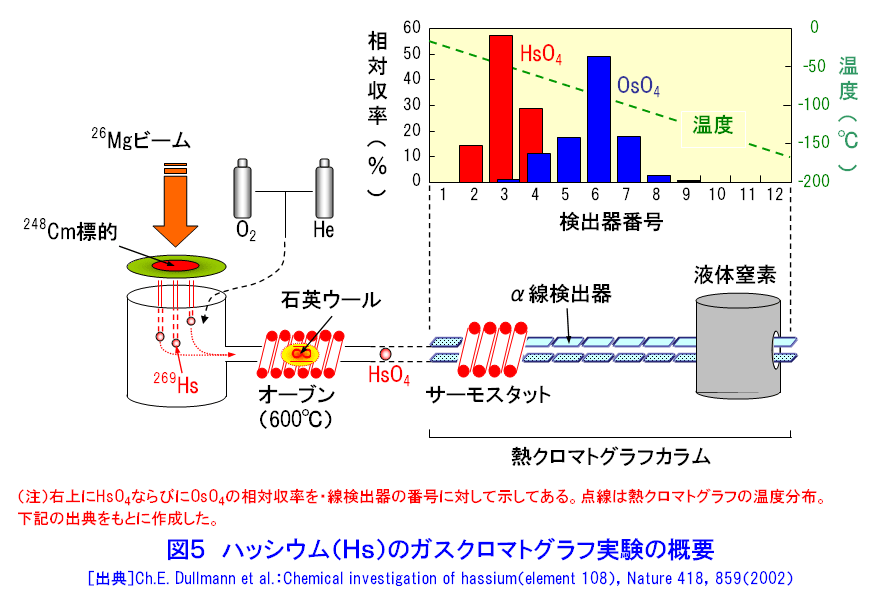
元素の周期表で104番元素ラザホージウム(Rf)より重い元素を超アクチノイド元素と呼び、第7周期に配置されている(図1)。超アクチノイド元素は人工的に重イオンを用いた原子核反応で合成されるが、その化学的性質を調べるには、どのような核種をどのような反応で合成するかを考慮しなければならない。超アクチノイド核種の半減期は短く、数十秒以下で壊変してしまう。したがって少なくとも化学操作を行い測定が終了するまでの間、対象とする核種が生存していなければならない。したがって、できるだけ長い寿命をもった核種を合成する必要がある。このため、一般には熱い核融合反応が用いられる(超アクチノイド元素の合成研究 <05-01-05-01> 参照)。超アクチノイド元素の化学的研究に用いられる核反応系、核種およびその半減期と生成率を示す(表1)。 1.シングルアトム化学 表1からわかるように、たとえば104番元素のRfで1分間に数原子、108番元素Hsにいたっては1日に数原子という割合である。しかも短い半減期で壊変してしまう。このため1個の原子が合成されても、次の原子が合成されるまで前に合成された原子は生き残っていることができない。つまり化学操作で一度に扱える原子の数はわずか1個であり、しかもそれを素早く分離分析して化学的性質を決めなければならない。このような化学をシングルアトム化学(atom-at-a-time chemistry)という。 通常の化学ではモル量、すなわち1023個レベルの原子を扱う。わずか数個の原子で、化学的性質を決めることができるのだろうか。当然シングルアトム化学では、マクロ量で扱われる熱力学的平衡論(質量作用の法則)は適用できない。しかし単一粒子を仮定した熱力学的関数を導入することで、質量作用の法則と等価の解釈ができると提案されている。例えば二相間における原子の分配は、1個の原子がどちらかの相で観測される確率として定義される。統計的な分配を考えれば、分配係数は二相分配の化学操作を多数回繰り返すことで、それぞれの相での原子の確率分布として求めることができる(図2)。また何段もの交換過程を経るクロマトグラフ法は、原理的には1個の原子でも統計的な挙動を反映していると考えることができる。このため速い化学平衡を伴うガスクロマトグラフ法や液体クロマトグラフ法などがシングルアトム化学では有効な分析手法となる。 超アクチノイド元素の化学実験は、以下のような4つの基本操作に分けられる。1)重イオン加速器を用いた超アクチノイド元素の合成、2)合成された超アクチノイド元素の化学分離装置への迅速な輸送、3)素早い化学分離操作と放射線測定のための試料調製、そして、4)目的の超アクチノイド核種の壊変に伴う放射線(主にα線)の測定。この一連の操作を迅速に数百回、数千回と繰り返し行い、統計的なクロマトグラフ挙動を調べる。 2.化学結合における相対論的効果 超アクチノイド元素のように重い原子では、中心にある原子核の正電荷が大きくなり、負電荷をもつ電子との相互作用が非常に強くなる。すると原子核の近くにあるsやp1/2電子(内殻電子)の速度は光速に近づき、相対論的効果で質量が重くなるため、その軌道半径が収縮する。一方、外側に位置するdやf電子(外殻電子)の軌道半径は、内殻軌道の収縮により原子核の正電荷の影響が遮へいされ逆に大きくなる。原子番号Zが大きい元素ほどこの効果は顕著に表れ、Z2とともに大きくなる。第7周期に属すると予想される超アクチノイド元素は原子価電子の軌道に変化が生じて、軽い同族の元素とは異なる化学的性質を示すことが期待される。 超アクチノイド元素の電子構造に関する研究は、超アクチノイド原子の性質、例えばイオン化ポテンシャル、原子半径(イオン半径)、酸化状態などを実験から求めることができれば、電子構造に関する情報が得られ、相対論的効果の影響をより直接的に観測することが出来る。しかし、シングルアトムでは種々の分光学的手法が適用できないため、以下に示すような化学的性質を通して相対論的効果の影響を見積もる試みがなされている。 3.超アクチノイド元素の化学的研究 世界的に超アクチノイド元素の化学的研究に取り組んでいるグループは、主に米国・ローレンスバークレー国立研究所(Lawrence Berkeley National Laboratory:LBNL)、ロシア・フレーロフ核反応研究所(Flerov Laboratory of Nuclear Reactions:FLNR)、ドイツ・重イオン研究所(Gesellshaft fur Schwerionenforshung:GSI)、スイス・ポールシェラー研究所(Paul Scherrer Institute:PSI)、そして(独)日本原子力研究開発機構(原子力機構)である。超アクチノイド元素の合成には放射性のアクチノイドターゲットを使用するため、特殊な照射設備等を有する加速器施設が必要で、このため限られた研究所でしか実験が遂行できない。以下に、最近、原子力機構のタンデム加速器施設で行われたRfの液体クロマトグラフに関する研究の一部と、ヨーロッパの核化学研究グループが行ったHsのガスクロマトグラフ実験の概要を紹介する。 4.原子力機構におけるラザホージウムの化学的研究 原子力機構での実験の概要を示す(図3)。タンデム加速器で108MeVに加速された18Oイオンをターゲットチェンバーに導き、248Cmターゲットを照射する。248Cm(18O,5n)反応で合成された261261は、反跳でターゲットから飛び出しエアロゾルと呼ばれる微粒子を含むヘリウム(He)ガス中にいったん捕獲される。エアロゾルに付着した261Rfは、Heガスのジェット気流で数秒のうちに化学実験室へと搬送され化学分離装置へと導かれる。この化学分離装置は、AIDA(Automated Ion−exchange separation apparatus coupled with the Detection system for Alpha spectroscopy)と呼ばれ、78秒で壊変する261Rfのイオン交換分離を迅速に行うため、200−300μLという微量な溶液で効果的な分離が行えるよう設計されている。内径1.6mm、長さ7.0mm(または内径1.0mm、長さ3.5mm)というマイクロカラムを用いて試料の溶解からイオン交換分離、α線測定までの一連の操作をコンピュータ制御で自動的に繰り返し行うことができる。イオン交換分離に要する時間は約20秒で、261RfをAIDAに捕集してから約80秒後にはα線測定を開始することができる。この分離操作を数千回と繰り返し行い、無機酸水溶液中でのイオン交換挙動を系統的に詳しく調べている。なかでもフッ化水素酸水溶液中(HF)でのRfの陰イオン交換樹脂への吸着挙動にきわめて興味深い結果が得られているので以下に紹介する。 ここでは4226回にも及ぶイオン交換実験から、261Rfに帰属するα壊変を266事象観測している。これは16回のイオン交換分離でようやく1個のRf原子を捕らえたことになる。Rfならびに周期表で同族元素となるジルコニウム(Zr)、ハフニウム(Hf)の陰イオン交換樹脂への吸着率とそれから見積もった分配係数(Kd)をフッ化水素酸濃度の関数として示す(図4)。興味深いのは、ZrとHfは全く同じKd値を示し勾配が -3であるのに対し、RfのKdはそれらより著しく小さくしかも勾配が -2となっている。これは陰イオン交換樹脂に吸着しているフッ化物イオンの化学種が、Zr/HfとRfとでは異なっている可能性を示唆している(詳細はまだ明かではない)。また最近の研究から、Rfがフッ化物を形成する力はZrやHfのフッ化物形成にくらべて著しく弱いこともわかってきた。さらに希薄なHF水溶液中で、Rfは RfF62-という化学種で溶存していることも明らかになった。フッ化物形成に見られるRfと同族元素との明らかな性質の違いが、果たして相対論的効果に起因しているのかどうか。定量的な理解のためには理論計算を含めた検討がさらに必要である。しかし、超重元素のシングルアトム化学で化学種を決定し、また同族元素との違いをこのように顕著に観測したのは初めてのことである。 5.ハッシウムのガスクロマトグラフ実験 次にヨーロッパの核化学研究グループが、248Cm(26Mg,5n)反応で半減期約14秒の269Hsを合成し、その揮発挙動をガスクロマトグラフ法で調べた成果を紹介する。周期表で同族の元素と期待されるオスミウム(Os)の四酸化物OsO4は室温でも揮発性の物質として知られている。このため以下のような実験が考案された(図5)。核反応で生成した269Hsはターゲットから飛び出し、Heと酸素(O2)の混合ガス中で捕獲され、ガスとともにオーブンを通過して四酸化物HsO4を形成する。生成したHsO4はガス気流で12対のα線検出器からなる熱クロマトグラフ部へと運ばれる。ここはサーモスタットと液体窒素によって20℃から -170℃という低温領域にまで温度勾配を与えてある。熱クロマトグラフと放射線検出器を兼ね備えたユニークな装置である。実験の結果、HsO4は -44℃で、OsO4は -82℃に相当する位置の検出器の表面に吸着していることが確認された。両者の吸着温度に差は見られるが、HsO4の揮発性はOsO4と同様に高く、まさしくHsO4が生成され、Hsが周期表第8族元素であると結論している。わずか7個の原子でHsの化学的性質を調べた成果である。 最近112番元素のガスクロマトグラフ実験がPSIとFLNRの共同で行われた。Hs実験で使用した装置を改良し、112番元素の吸着を調べたところ水銀(Hg)の挙動と似ていることを見出している。ここではわずか2原子の挙動に基づいている。 超重元素の化学に関する詳しい情報については、文献を参照していただきたい。 <図/表> 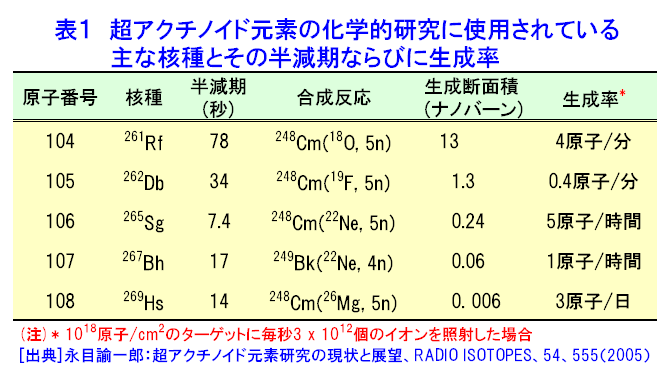
<関連タイトル> 超アクチノイド元素の合成研究 (05-01-05-01) <参考文献> (1)永目諭一郎:超アクチノイド元素研究の現状と展望、RADIO ISOTOPES、54、555(2005) (2)篠原厚、塚田和明、永目諭一郎:超重元素の化学的研究、日本物理学会誌、60、709(2005) (3)M.Schadel(ed.),The Chemistry of Superheavy Elements,Kluwer Academic Publishers,Dordrecht(2003) (4)M. Schadel,Chemistry of superheavy elements,Angew. Chem. Int. Ed. 45,368(2006) (5)Ch.E. Dullmann et al.:Chemical investigation of hassium(element 108),Nature 418,859(2002) (6)H. Haba et al.:Fluoride complexation of element 104,rutherfordium,J. Am. Chem. Soc. 126,5219(2004) (7)R.Eichler et al.:Chemical characterization of element 112,Nature 447,72(2007) (8)A.Vertes,S.Nagy and Z.Klencsar,(eds.),Handbook of Nuclear Chemistry,Vol.2,Elements and Isotopes,Kluwer Academic Publishers,Dordrecht(2003) (9)L.R. Morss,N.M. Edelstein and J.Fuger J.(eds.),The Chemistry of the Actinide and Transactinide Elements(3rd Ed.),Vol.3,Springer,Dordrecht(2006) (10)J.Magill,G.Pfennig and J.Galy,Karlsruher Nuklidkarte(7th Ed.),European Commission − DG Joint Research Centre − Institute for Transuranium Elements,Karlsruhe(2006)
|

