|
<解説記事ダウンロード>
<概要>
ポジトロンイメージングは、β+崩壊を起こすポジトロン放出核種で標識した化合物をトレーサに用いて、その生体内での動態を非侵襲で画像化できるユニークな放射線計測技術である。植物ポジトロンイメージング技術は、これを植物による栄養成分の吸収や、植物体内での動態を個体レベルで画像化し、植物内で行われる栄養成分の輸送や分配に関する生理機能を明らかにするためのものである。植物ポジトロンイメージング技術の中核は植物ポジトロンイメージング装置(PETIS)であり、計測を2次元平面に限定することにより、同じ原理による3次元計測に比べ、高い空間分解能とS/N比を実現している。PETIS計測の結果は動画像として得られ、画像を構成する1画素の大きさは約1mm×1mmである。PETISは画素毎に計測データを蓄積しているので、画像上に設定した任意の領域における放射線強度の経時変化を抽出できる。抽出したデータを植物の特性を考慮した数理的な手法で解析することにより、トレーサの移行速度や輸送過程での損失割合など、数値に変換した植物機能をトレーサの移行経路上にマッピングすることが可能となった。 <更新年月> 2006年11月
<本文>
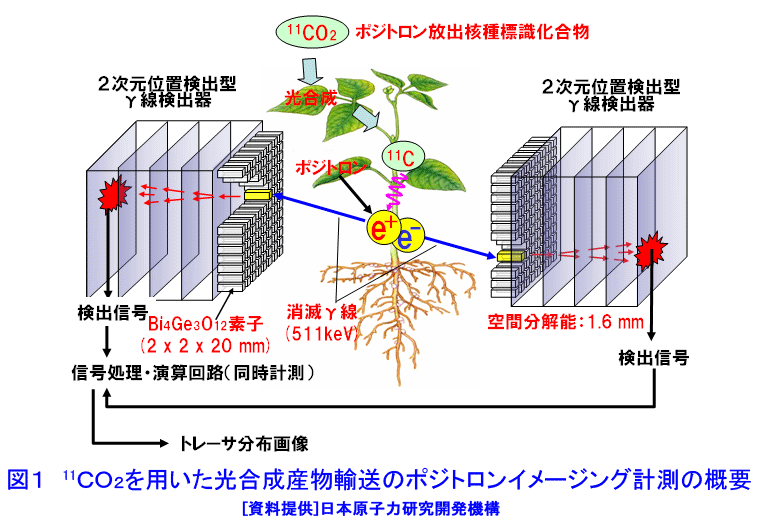
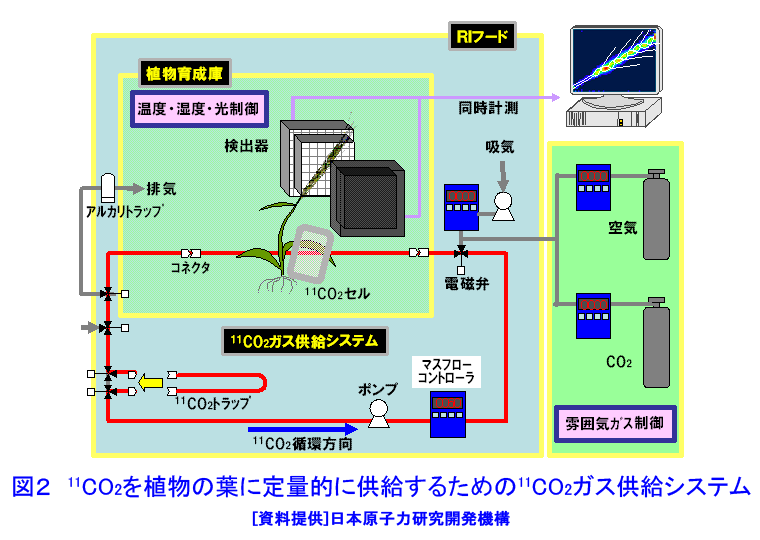
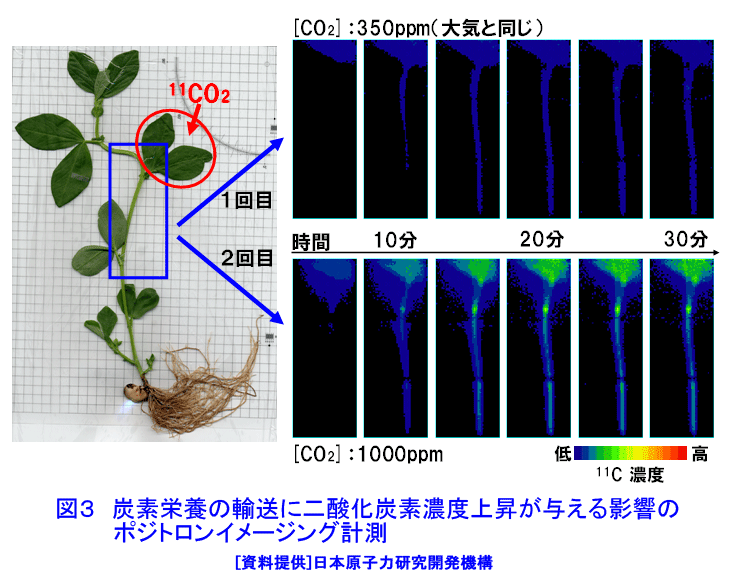
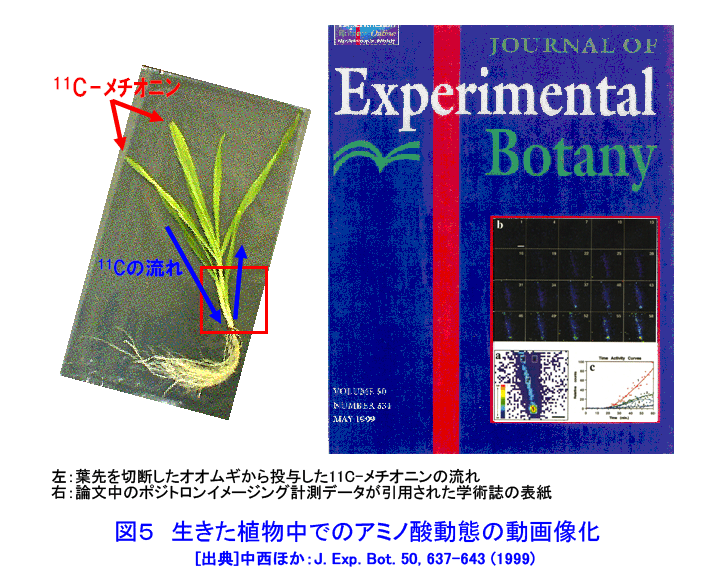
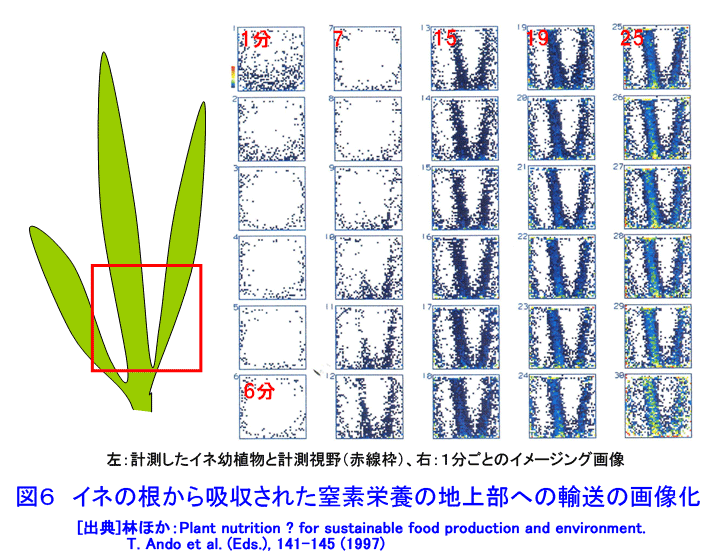
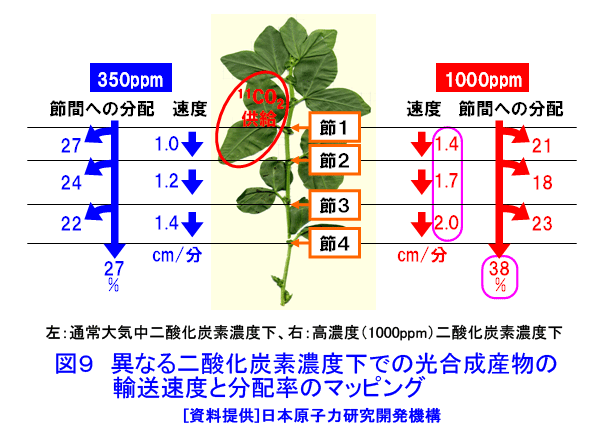
1.植物ポジトロンイメージング計測 植物ポジトロンイメージング装置(Positron Emitting Tracer Imaging System, PETIS)は、生きた植物の体内で行われている物質の移動や蓄積を、経時的に可視化するために原研(現、日本原子力研究開発機構)と浜松ホトニクスが共同で開発した装置である(参考文献1)。光合成産物のイメージングを例にしたPETIS計測の概要を図1に示す。ポジトロン放出核種である11Cで標識された二酸化炭素(11CO2)は、植物の葉から吸収・同化されて、11Cで標識された光合成産物となり、植物の各組織へと輸送される。光合成産物中の11Cでは崩壊に伴って原子核外にポジトロン(陽電子、電子の反粒子)を放出する。放出されたポジトロンは、周囲に存在する電子とともに対消滅し、それぞれの粒子の質量に相当するエネルギーを持ったγ線(消滅γ線、511keV)となる。消滅γ線は同時に発生し、互いに反対方向に進む性質を持つ。そこで、対向配置した2次元位置検出型γ線検出器に同時に入射したγ線を特定し、それぞれの検出器への入射位置からポジトロンの消滅位置求め、経時的な光合成産物の分布画像を構築する。 植物ポジトロンイメージングは、以下のような点で、植物個体の機能を研究する手法として優れた計測法といえる。 (1)物質透過力の高いγ線を計測する。ポジトロン放出核種に由来する消滅γ線は容易に植物組織を透過するので、14Cのβ線を計測するオートラジオグラフのように試料薄切片を作成し、フィルム面に密着させる必要がない。また、トレーサを植物の根や葉から組織を傷つけることなく吸収させられるので、非接触・非侵襲での計測が可能である。 (2)PETISは、小型の植物が一平面上に配置できることを活かし、2次元画像の構築に機能を限定した。その結果、PET(Positron Emission Tomography、ポジトロン断層診断)のように3次元画像を再構築する必要が無いためリアルタイムでの画像化が可能となり、PETに比べ高いS/N比と空間分解能を実現している。 (3)PETISは、画像を構成するすべての画素(1画素の大きさは1.1mm×1.1mm)について、検出した放射線強度の経時変化をデータとして蓄積している。従って、視野(W 12cm×H 19cm)内の任意の領域について、注目する物質動態の定量的な解析が行える。 (4)PETISは、消滅γ線を検出するため、ポジトロン放出核種であれば元素の種類にかかわらず同じ装置で計測が可能である。原子力機構はこれまでにPETIS計測用トレーサとして炭素や窒素など植物の主栄養素や、鉄、マンガン、亜鉛など必須金属元素やカドミウムを開発している(表1)。 (5)ポジトロン放出核種には、11C(20分)や13N(10分)に代表されるように半減期が短いものがあり、計測終了後にしばらくの冷却時間を設けることにより、植物内に取り込まれたポジトロン放出核種がPETISによる検出限界以下にまで減衰させることができる。このため、同一個体を用いて複数回の計測を行うことができ、異なる環境条件下での植物機能の応答などを、個体差の影響を受けることなく同一個体で調べることができる。 このような特徴を持つPETISを用いることにより、通常の研究手法では見ることができない、生きた植物個体内での栄養成分や環境汚染物などの動態の可視化が可能となり、その画像データを解析することにより植物が持つ機能を明らかにする研究が進められている。 2.光合成産物など炭素化合物 光合成は、植物が炭素栄養を獲得する手段である。植物が外界から取り込んだ二酸化炭素は、光合成を経て糖(光合成産物)へと変換される。光合成産物は篩管を通って植物の各器官へと輸送され、植物体の形成やエネルギー源として利用される。光合成に関する研究では、葉における二酸化炭素の同化速度を測定する手法が現在の主流となっている。この手法では、「葉がどれだけの炭酸ガスを同化したか」という情報は得られるが、「同化された光合成産物がどこに・どれだけ輸送されたか」という情報は得られない。松橋らはPETISを用いることにより、植物個体内での光合成産物の動きを画像として捕らえることに成功している。さらに、取り扱いが困難なガス状トレーサである11CO2を植物の環境(光、温度、湿度、雰囲気ガスの成分組成・濃度)を保ちながら植物の特定の葉のみに暴露させる11CO2ガス供給システム(図2)の開発を進めている(参考文献2)。このシステムを用いて光合成産物の動態を可視化することにより、二酸化炭素の同化速度の計測だけではわからない、炭素栄養の輸送機能に関する知見が得られている。図3は、炭素栄養の輸送に雰囲気の二酸化炭素濃度上昇が与える影響を、11CO2を用いたPETIS計測で調べた例である。光合成産物が輸送される状況を可視化することにより、二酸化炭素濃度の上昇が葉から送り出される光合成産物の量を増加させるだけでなく、光合成産物の輸送自体も速めていることが両者の画像の比較からわかる。この観察では、11Cの半減期が20分であることを利用し、ソラマメの同一個体に対して、異なる二酸化炭素濃度下で2回のイメージング計測を行うことで、個体差の影響を受けることなく、環境変化が与える影響を可視化することに成功している。また、藤掛ら(参考文献3)は、ダイズ幼植物の根を2群に分け、それぞれの根の栄養条件を制御する方法を取り入れ、同一を用いてマメ科植物の窒素栄養獲得で重要な役割を果たす根粒への光合成産物の輸送・分配の可視化により、硝酸の存在により光合成産物の根への輸送が促進される現象を見出している(図4)。 光合成により同化された炭素栄養は、植物内において様々な化合物へと代謝され、植物の生命活動に利用される。単子葉植物であるオオムギは、微量栄養素である鉄が欠乏すると、土壌中から鉄を吸収するために根からムギネ酸というキレート物質を分泌する。ムギネ酸はアミノ酸であるメチオニンから生合成されることがわかっている。しかし、メチオニンは様々な化合物の前駆物質であることから植物体内にはメチオニンが普遍的に存在している。このため、ムギネ酸の生合成に関与するメチオニンだけを分けて観察することは、これまで実現していなかった。Naimatullahら(参考文献4)は、ムギネ酸を合成するためのメチオニンの由来を明らかにするために、11CO2を出発物質とした有機合成により11Cで標識したメチオニンを作成した。種々の処理を施したオオムギ体内での移行をPETISで観察した結果、ムギネ酸の生合成に用いられるメチオニンが植物体の根に由来することを明らかにした。これに先立つ中西ら(参考文献5)の計測は、生きた植物内でのアミノ酸の移行を可視化に成功した世界で初めての成果として、その画像が植物研究の専門誌の表紙を飾った(図5)。 3.窒素化合物 窒素は、炭素とともに植物にとって重要な栄養素であり、植物による窒素の吸収、移動、利用などの研究は現在でも植物栄養学の中心的な課題である。植物が利用する窒素栄養としては、水稲などが利用するアンモニウムイオン(NH4+)、多くの畑作物が利用する硝酸イオン(NO3-)、ダイズなど窒素固定菌(根粒菌)と共生できる植物が利用する空気中の窒素ガス(N2)がある。 林ら(参考文献6)は、イネ幼植物の根に13NO3-を供給し、葉鞘への移行をPETISで観察し(図6)、13NO3-供給からわずか8分後には葉鞘へ移行していることを観察した。同じ窒素栄養でも13NH4+をイネ幼植物の根に供給した場合には、葉鞘の基部に2分以内に到達することを清宮ら(参考文献7)が明らかにしている。大竹ら(参考文献8)は、窒素栄養状態のことなるダイズを用いて、切断した茎から13NO3-を吸収させ、莢への13Nの移行をPETISで計測した。その結果、窒素栄養状態に関わらず、13NO3-の吸収から10〜20分で莢近くの茎に13Nが到達することを観察した。一方、さやへの窒素栄養の取り込みを見ると、窒素栄養が欠乏状態にあるダイズでは13NO3(-)吸収から20分以降に莢への13Nの蓄積観察できたのに対し、窒素栄養が十分なダイズでは40分後でも莢への13Nの移行はほとんど見られず、窒素栄養の欠乏がダイズの莢への窒素輸送機能を促進することを示した(図7)。 清宮ら(参考文献7)は、アンモニア同化酵素(グルタミン合成酵素)の阻害剤を根から吸収させると、窒素の地上部への移行がほぼ抑制されルことも観察している。この結果は、根から吸収されたアンモニアはそのままの化学型で導管中を移行するのではなく、グルタミンなどに代謝された後に移動すること意味しており、生理活性物質を利用したPETIS計測を行うことにより、植物が持つ生理機能をものの動きとして可視化できることを示している。川地ら(参考文献9)は、オオムギ幼植物体での硝酸の導管輸送に対する陰イオンチャネルブロッカーの効果をPETISによる13NO3-移行を可視化することにより調べている。 4.水 水はすべての生命にとって根源であり、外界からの物質の取り込みや体内での物質の移動に重要な役割を果しているが、生きた植物内での水の動きを直接観察することは困難であった。生体内での水の動きを見るためのトレーサとしては、ポジトロン放出核種である15Oの利用が考えられるが、半減期がわずか2分と非常に短いため、RIの製造から計測までを一貫して短時間で行う必要がある。森ら(参考文献10)はトマトとイネの幼植物による15Oで標識した水(H215O)の吸収後の動態をPETISで計測し、生きた植物内での水の動きの可視化に世界ではじめて成功した(図8)。根から吸収されたH215Oは、いずれの植物でも3分後までに地上部に移行する様子が観察され、光を当てている時だけ水の移動が行われることが確認された。その後、清宮らは、イネ幼植物を用いて光環境の変化が水の移行にどのような影響を与えるかを詳細に検討し、光に応答した気孔の開閉に約10分が必要であることを示した。さらに、13N標識アンモニア(13NH4+)とH215Oの動きについても比較し、暗環境に置くと、根から地上部への水の動きは完全に停止するが、窒素は光が当たっている時の移行量の約40%維持されるという興味深い現象を見出している(参考文献7)。 5.可視化した画像データの解析 PETIS開発当初の目標は、植物内での栄養成分などの動態を視覚的に理解するための動画を取得することであった。しかし、動画化したPETISのデータによる視覚的な物質動態の理解は、直感的なものであり、植物の生理機能を定量的に捕らえるためには、意味のある数値への変換、すなわちデータの定量解析が必要となる。PETISデータが1画素ごとに持つ時間軸に対する測定値をもとに、画像上の任意の領域(ROI,region of interest)におけるトレーサ分布の経時変化をグラフ(TAC, time activity curve)化し、解析することができる。TACから直接得られるグラフの立ち上がり、グラフの傾きや飽和点は、あくまでも目安の値にすぎない。そこで、Keutgenら(参考文献11)は、PETISデータの伝達関数法による解析についてその可能性を示した。さらに松橋ら(参考文献12)は、近接した領域(ROI)におけるデータへの適応も可能であることを示した。この手法により、葉で固定された光合成産物が茎の上流部から下流部にかけて移行する際の茎中での詳細な速度分布を求めることに成功し、栄養成長期にあるソラマメでは、根に近づくほど光合成産物の輸送速度が大きくなることを示した。また、速度と同時に輸送中に積みおろされた割合(分配率)も求められ、シンクーソース機能の解析の有力なツールとなることを示した(図9)。 このように、RIを用いた生きた植物内での物質動態の可視化技術は、今後一層、植物機能の解明研究の飛躍的な進展に貢献すると考えられる。 <図/表> 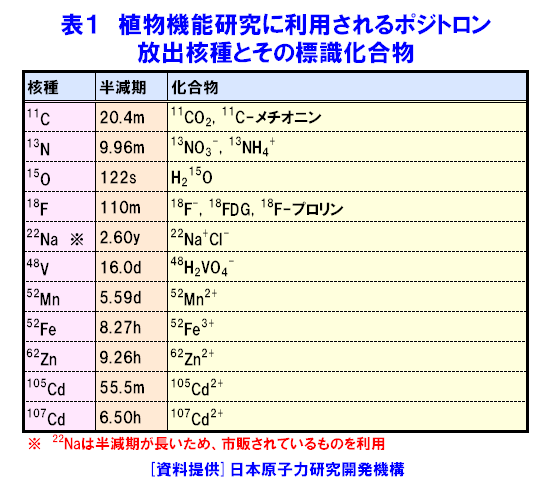



<関連タイトル> 放射線による植物機能の解明 (08-03-01-05) 植物中の水のイメージング (08-03-01-06) イオンビームバイオ技術の現状 (08-03-01-07) PETの原理と応用 (08-02-01-04) <参考文献> (1)T. Kume,at al.:Appl. Radiat. Isot. 48,1035−1043 (1997). (2)S. Matsuhashi,at al.:Appl. Radiat. Isot. 64, 435-440 (2006). (3)T. Fujikake,at al.:J. Exp. Bot. 54(386), 1379-1388 (2003). (4)B. Naimatullah,at al.:Planta, 213, 708-715 (2001). (5)H. Nakanishi,at al.:J. Exp. Bot. 50, 637-643 (1999). (6)H. Hayashi,at al.:Detection and characterization of nitrogen circulation through the sieve tubes and xylem vessels of rice plants. Plant nutrition - for sustainable food production and environment. T. Ando et al. (Eds.),1997,p.141-145. (7)S. Kiyomiya,at al.:Plant Physiol. 125, 1743−1754 (2001). (8)N. Ohtake,at al.:Rapid N transport to pods and seeds in N-dificient soybean plants. J. Exp. Bot. 52(355), 277-283 (2001). (9)T. Kawachi, C. at al.:Soil Sci. Plant Nutr. 48, 271-277 (2002) (10)S. Mori,at al.:Soil Sci. Plant Nutr. 46, 975-979 (2000). (11)N. Keutgen,at al.:Appl. Radiat. Isot. 57, 225-233 (2002). (12)S. Matsuhashi,at al.:Soil Sci. Plant Nutr. 51 417-423 (2005).
|

