|
<解説記事ダウンロード>
<概要>
著しく高い放射線耐性を示す放射線抵抗性細菌であっても、細胞内のDNAは他の生物と同じような効率で放射線による損傷を受け、特別なDNA保護機構が細胞内に存在する訳ではない。放射線に強い原因は、DNAに生じた種々の損傷を全て正常な形にもどしてしまう修復機構が存在することによっている。この修復機構には、既知の除去修復反応が関係すると考えられるが、組換え修復反応の関与は明らかではなく、更に未知の修復反応が関係することが示唆されている。この未知の修復反応にあずかる酵素系は、細胞が照射された後に誘導合成される蛋白質であり、これらの蛋白質の解析とその遺伝子の解析から新たな修復機構が解明されつつある。 <更新年月> 1998年03月
<本文>
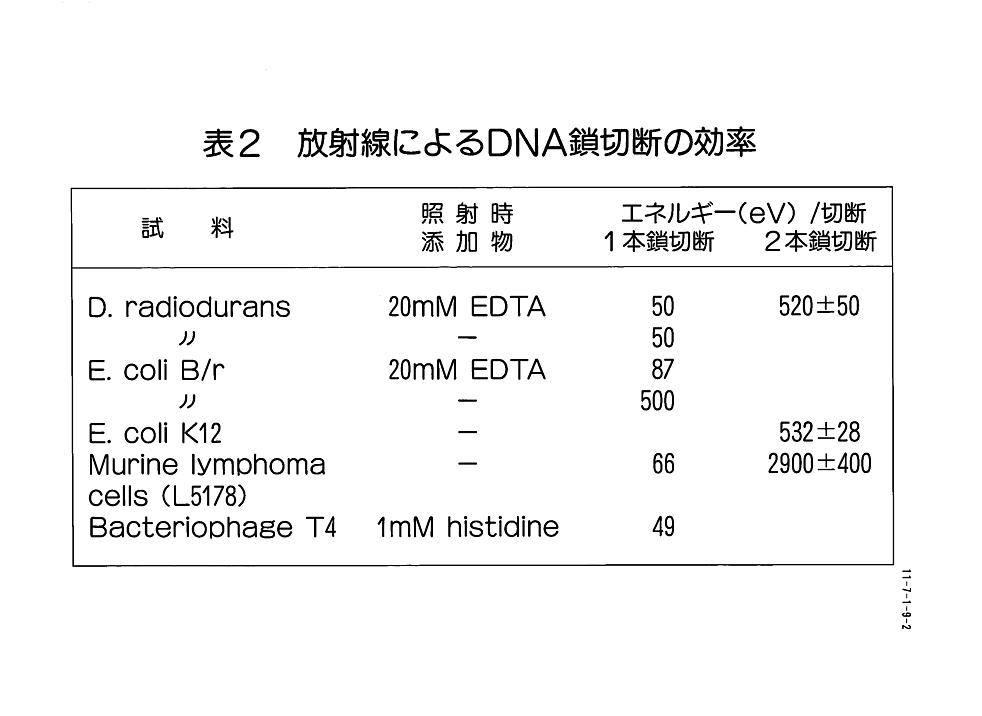
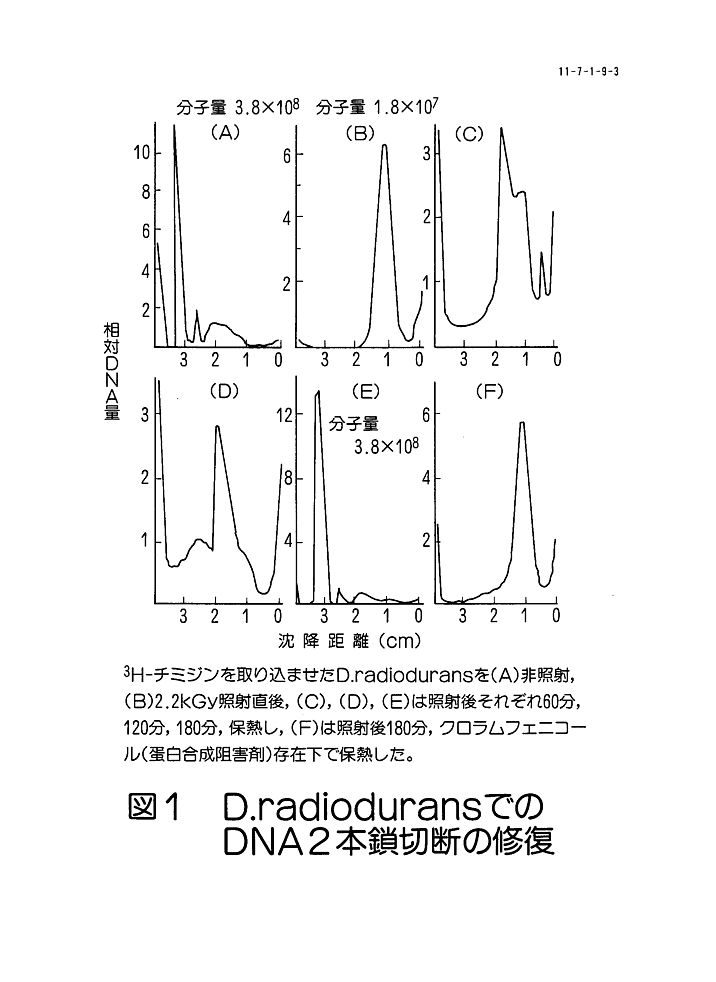
1.放射線によるDNAの損傷 放射線のエネルギーが細胞に吸収されると細胞内に種々の損傷が生じる。このとき蛋白質やDNAなどの生体物質に直接エネルギーが吸収されて損傷が生じる場合を直接作用と言い、またエネルギーが細胞内の水に先ず吸収され、水の放射線分解から生じた活性種によって損傷を起こす場合を間接作用と言う。一般に放射線による致死効果の50%が直接作用によっており、残り50%が間接作用である。またこの間接作用の主役はOHラジカルであることが多い。放射線抵抗性細菌といえども直接作用と間接作用の割合は、通常の細胞と変りがない。放射線による致死効果の直接的な原因はDNAの損傷であり、その損傷の中には、核酸塩基の変化と鎖の切断及び架橋などがある。これらの損傷の中では、核酸塩基の変化が最も多い。塩基の中でもピリミジンの方がプリンよりも感受性が2倍程高く、放射線で分解しやすい。鎖の切断では1本鎖が切れる場合と、2本鎖が切れる場合がある。これらの損傷が起こる頻度を大まかに言えば、塩基損傷が2〜3個起こるとき、1本鎖切断が1個生じ、そのとき14〜16個の水素結合が開裂する。2本鎖切断が起こる頻度は、1本鎖切断の6〜8分の1であり、水素結合が開裂する範囲にもう1つの1本鎖切断が生じると2本鎖切断となる。また、架橋には、DNA分子内、分子間、DNAと蛋白質の架橋などがあり、約5個の2本鎖切断に対して1個の分子間架橋が生じるといわれているが、正確な効率は分っていない。細胞当りに生じるDNA切断の数を哺乳動物細胞で計算した結果では、細胞当り5×10E12ダルトンの大きさのDNAが存在したとして、1Gy照射したときに1細胞に生じるDNA切断の数は、1本鎖切断が約 650個、2本鎖切断が約45個である。 2.放射線耐性に関与する要因 放射線抵抗性細菌として最初に発見されたこともあって、放射線耐性とDNA修復機構の研究は、ほとんどディノコッカスラジオデュランス(Deinococcus radiodurans)に集中している。 表1 はこの細菌の放射線耐性の原因としてこれまでに検討された種々の要因をまとめたものである。 耐性の原因として最初に研究されたのは、DNAが放射線の作用から保護されている可能性である。これは細胞内のシステインやグルタチオンなどのSH化合物のような保護物質によってDNAが保護されているとか、DNAの構造や塩基組成が損傷を受けにくくしているとか、DNAに吸収された放射線エネルギーが他の物質に転移して損傷の生成を防いでいるとか、酵素の作用によってDNAに生じたラジカルや過酸化物が除去されるなどの可能性である。しかし、 表2 に示したように、D.radiodurans での1本鎖切断や2本鎖切断に必要なエネルギーは、実験によるバラツキはあるものの、大腸菌やその他の放射線に弱い細胞とほとんど同じである。この結果から、放射線抵抗性細菌のDNAが放射線の作用から何等かの保護を受けている可能性はほとんどないことが明らかになった。次にD.radiodurans は4〜9本の重複した染色体を持っており、少なくともその内の1本が無傷であれば生存できるから、それが放射線耐性の原因であるという可能性である。この点に関しては、照射後の超遠心分離によるDNA分析で無傷のDNAが検出されないということや、耐性のない他の細菌でも重複した染色体を持っていることが知られていることから、単に複数のコピーを持っているだけでは不充分であり、そこには染色体間の相互作用が必要であると推定される。しかし、それを証明する実験事実は得られていない。現在、最も有力な要因と考えられているのは、DNAが損傷を受けても、ある線量範囲では全て修復でき、修復が終了するまでDNAの複製を停止させておくという調節機構が働いているということである。 D.radiodurans の生存曲線は大きな肩を持っており、約5kGyまで生存率は変化しない。即ち、この範囲ではDNAに生じた損傷がすべて修復されていることになる。この生存曲線の肩の範囲の線量では、普通の細菌では致死原因となるDNAの2本鎖切断が完全に修復されることが分っている。 図1 に示すように、照射前に 3.8×10E8 であったDNAの分子量が2.2kGy照射後には 1.8×10E7 に減少するが、照射後の培養中に回復して、180 分後には完全に照射前の分子量にもどる。しかし、照射後の培養中に蛋白合成阻害剤である抗生物質を入れておくと、DNA分子量の回復は起こらず、修復には照射後の新たな蛋白合成が必要であることを示している。 3.DNA損傷の修復 生物はさまざまなDNA損傷を処理するための精緻な修復機構を持っている。これまで知られている機構を示すと次のようになる。(1) 光回復:紫外線照射によって生じるピリミジンダイマーが光回復酵素と可視光の作用で元にもどる。(2) 除去修復:紫外線やX線、γ線照射によって起こる塩基損傷や1本鎖切断の損傷部位を先ず切断して取り除いた後、DNA合成酵素が作用して取り除いた1本鎖の穴を埋める。(3) 組換え修復:損傷を持っているDNAが複製過程に入ると傷のある所で複製は停止し、傷のないもう1本の鎖はそのまま複製された後、この鎖が組換えられて、傷のために複製できなかった部分を埋める。このような機構によって、正確にDNAが複製されれば細胞は正常に増殖しうるが、放射線損傷を受けたDNAに修復ミスが起こると突然変異を起こすことになる。 D.radiodurans では5kGyまで生存率が変化しないだけでなく、この範囲では突然変異がほとんど起こらない。このことはDNA修復が非常に正確に行われていることを示している。またこの修復には、これまでに除去修復に関係する酵素が見出されていることから、この機構が存在することは確かである。一方、D.radiodurans の耐性株であるRIから誘導した放射線感受性変異株の中で、rec 30株と KH840株は親株のように生存曲線での大きな肩を持たず、大腸菌とほぼ同程度の感受性を示す。rec 30株は組換え能を欠損しているが、KH840 株は親株と同程度の組換え能を持っていることから、組換え修復だけで著しく高い耐性を説明することは困難であり、未知の修復機構が存在することが示唆されている。この修復反応には、照射後の新たな蛋白合成が必要であるから、照射後に誘導されてくる蛋白質が修復系に関係する可能性が高く、これまでに10数種類の誘導蛋白質が見出されて、耐性との関係が調べられている。その中には、放射線感受性変異株では誘導されず、放射線耐性株だけに誘導される蛋白質があり、これらの蛋白質の機能を解説することによって修復反応に関与する酵素系の解明ができるものと期待される。また、修復系に関与する遺伝子の解析については、除去修復に関連する遺伝子のクローニングが進んでいるが、2本鎖切断の修復に関与する遺伝子はまだ明らかになっていない。放射線耐性の遺伝子解析で最も大きな技術的障壁は、D.radiodurans のDNAが大腸菌や枯草菌のベクター系では非常に不安定であり、それらの系を使うことができないことである。そのため、D.radiodurans から分離したプラスミドDNAを用いて、新たなベクターを構築しようという研究が進められており、完成すれば2本鎖切断の修復に直接関与する遺伝子を解析する研究が飛躍的に前進するものと期待される。 <図/表> 
<参考文献> 1)渡辺宏;放射線による細胞損傷と修復機構、放射線化学、Vol.54、p2−9 (1992) 2)渡辺宏;放射線抵抗性細菌とその修復機構、バイオサイエンスとインダストリー、Vol.47、p.24-29 (1989) 3)北山滋;耐放射線微生物、極限環境微生物ハンドブック、p.435-440 (1991)
|

